Describir la experiencia del abordaje robótico en la cirugía de la acalasia en un centro de tercer nivel.
Material y métodosSe analizaron los pacientes con acalasia intervenidos mediante cirugía robótica entre mayo de 2010 y abril de 2019. Las variables a estudio se recogieron en una base de datos prospectiva y se realizó un análisis descriptivo.
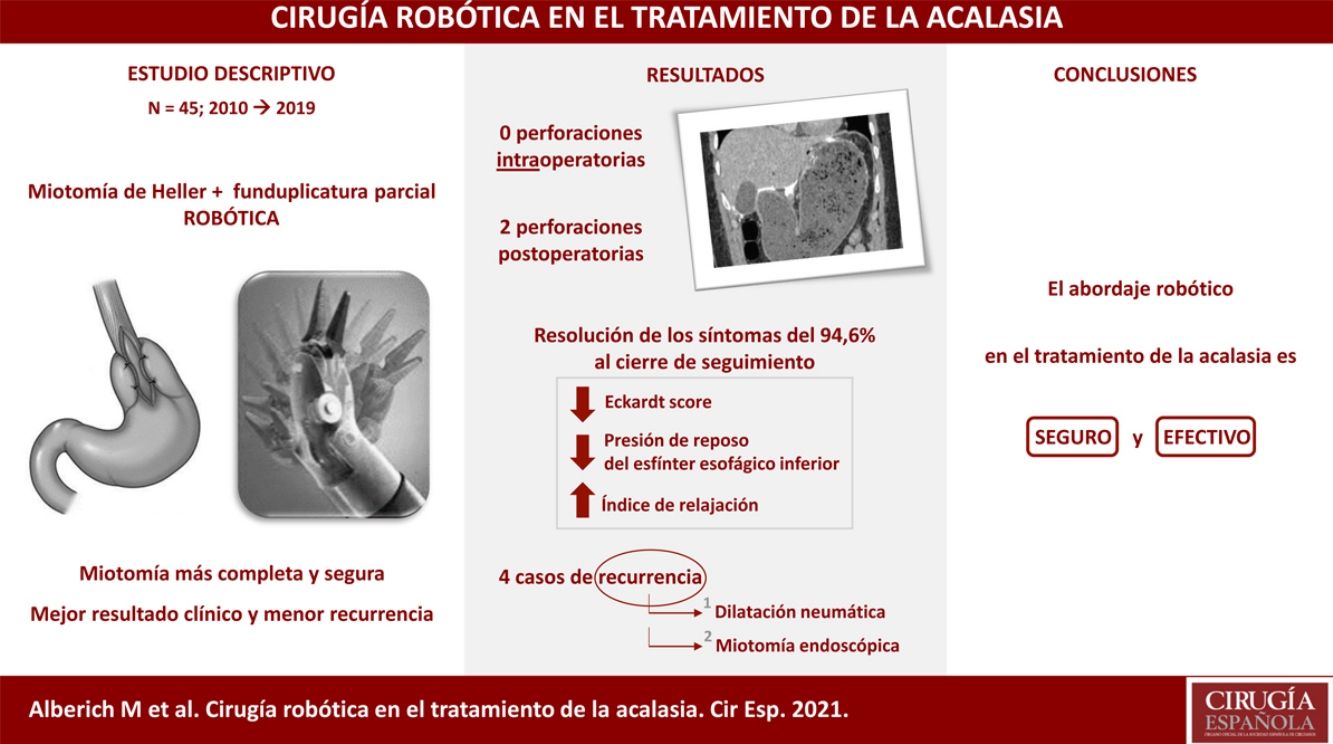
ResultadosSe incluyeron 45 pacientes (55,6% varones) con edad media de 44 años. El síntoma principal al diagnóstico fue la disfagia. Diecinueve pacientes (42,2%) habían recibido tratamiento endoscópico previo a la cirugía, mayoritariamente dilatación neumática (84,2%). La técnica quirúrgica empleada fue la miotomía de Heller asociada a funduplicatura tipo Toupet, con un tiempo operatorio medio de 211 minutos. La estancia media fue 5 días. Se produjeron 2 perforaciones postoperatorias (4,4%). La mortalidad peroperatoria fue del 0%. El seguimiento medio fue de 64 meses. A 3 y 5 años se evidenció una importante disminución del Eckardt score y el estudio manométrico mostró una disminución de la presión del esfínter esofágico inferior en reposo media del 58% y del 70%, respectivamente, con persistencia de hipomotilidad del cuerpo esofágico. En dos pacientes (5,4%) se diagnosticó reflujo gastroesofágico patológico y 4 (10,8%) presentaron recurrencia de los síntomas, requiriendo dilataciones neumáticas endoscópicas. En 2 casos las dilataciones no fueron efectivas por lo que se planteó la realización de una miotomía endoscópica.
ConclusionesSegún nuestra experiencia, la cirugía robótica constituye un procedimiento seguro y efectivo para el tratamiento de la acalasia.
To describe the experience of the robotic approach for achalasia surgery in a tertiary center.
Material and methodsPatients with achalasia who underwent robotic surgery between May 2010 and April 2019 were analyzed. The study variables were collected in a prospective database and a descriptive analysis was performed.
Results45 patients (55.6% male) with a mean age of 44 years were included. The main symptom at diagnosis was dysphagia. 19 patients (42.2%) received endoscopic treatment prior to surgery, mostly pneumatic dilation (84.2%). Heller's myotomy associated with Toupet fundoplication was the surgical technique of choice, with a mean operative time of 211minutes. The average stay was 5 days. There were 2 postoperative perforations (4.4%). Perioperative mortality was 0%. The mean follow-up was 64 months. At 3 and 5 years, a significant decrease in the Eckardt score was observed and the manometric study showed a decrease in the lower esophageal sphincter pressure at rest of 58% and 70%, respectively, with persistence of hypomotility of the esophageal body. Pathological gastroesophageal reflux was diagnosed in two patients (5.4%) and 4 (10.8%) presented recurrence of symptoms, requiring endoscopic pneumatic dilations. In 2 cases, the dilations were not effective, so an endoscopic myotomy was considered.
ConclusionsIn our experience, robotic surgery is a safe and effective procedure for the treatment of achalasia.
La acalasia es un trastorno infrecuente de la motilidad esofágica, de etiología desconocida, caracterizado por una incapacidad del esfínter esofágico inferior para relajarse y una aperistalsis del cuerpo esofágico1. La disfagia es el síntoma principal y la técnica quirúrgica considerada de elección para su tratamiento es la miotomía de Heller asociada a funduplicatura parcial laparoscópica1,2. A pesar de la probada seguridad y eficacia a largo plazo de este abordaje, en series publicadas por centros con gran experiencia se ha descrito una recurrencia del 10% y hasta un 15% de perforaciones intraoperatorias3–5. Estudios recientes sugieren que estos resultados podrían mejorarse gracias a la mejor visualización y mayor amplitud de movimientos que aporta la cirugía robótica, permitiendo la realización de una miotomía más completa y segura (0-7% de perforaciones intraoperatorias), con el consiguiente mejor resultado clínico y una tendencia a una menor recurrencia3,6-10,16,17.
El objetivo de este estudio es presentar los resultados del abordaje robótico en la cirugía de la acalasia.
Material y métodosSe realizó una revisión de los pacientes con acalasia intervenidos mediante cirugía robótica entre mayo de 2010 y abril de 2019 en la Unidad de Cirugía Esofagogástrica del Hospital Universitario de Bellvitge. Se recogieron variables demográficas, clínicas, diagnósticas, quirúrgicas y evolutivas en una base de datos prospectiva. El cierre de seguimiento fue septiembre de 2020.
El diagnóstico se realizó en base a datos clínicos, radiológicos (esofagograma y en ocasiones también tomografía computarizada) y endoscópicos, descartándose seudoacalasia causada por tumores. En todos los casos se confirmó con manometría esofágica (de tipo convencional en la gran mayoría de los pacientes dado que en nuestro centro la de alta resolución no se introdujo hasta julio de 2020).
A la inclusión en lista de espera y en los controles ambulatorios después de la cirugía se valoraron los síntomas usando el Eckardt score. Todos los pacientes fueron intervenidos por el mismo equipo quirúrgico. A las 48 o 72 h posquirúrgicas, según disponibilidad, se realizó una prueba de imagen con contraste oral y en caso de no detectarse fugas ni otras complicaciones se inició dieta líquida.
Tras la cirugía, se realiza seguimiento clínico en consultas al mes, a los 6 meses y posteriormente anualmente. Se realizan controles endoscópicos, manométricos y con pH-metría a los 3 y a los 5 años.
Se consideró recurrencia de la enfermedad a la necesidad de intervención para tratar síntomas después de la cirugía.
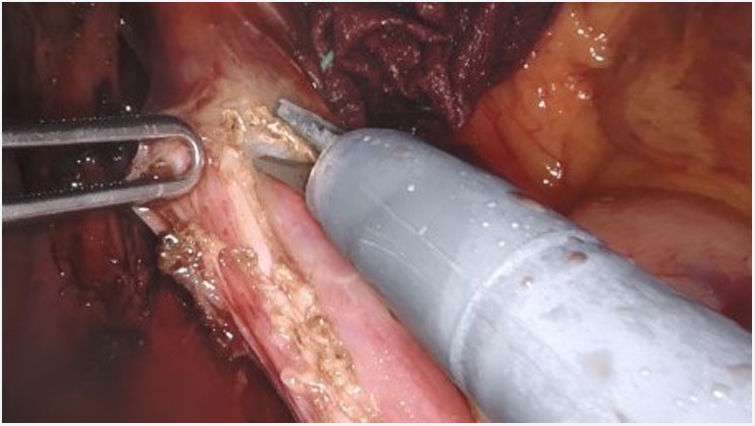
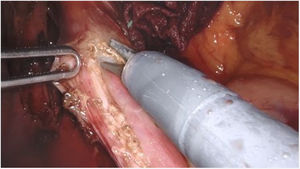
Técnica quirúrgicaSe utiliza la versión Si del sistema quirúrgico Da Vinci, con un carro de cuatro brazos, de los cuales se usan tres. El paciente se posiciona en decúbito supino. El neumoperitoneo se realiza con aguja de Veress en hipocondrio izquierdo. Se utilizan 5 trócares: uno epigástrico de 8mm, dos paramediales derecho e izquierdo de 8mm y 2 laterales de 5mm. A continuación, se acopla el robot. Se inicia el procedimiento con la apertura del epiplón menor, seguido de la disección de los pilares diafragmáticos y del esófago intraabdominal, preservando las ramas vagales. Se seccionan los vasos cortos. Se realiza una miotomía longitudinal de 10cm de longitud que se prolonga 8cm proximalmente desde el cardias y 2cm distalmente hacia el estómago, con preservación del plano submucoso (fig. 1). La técnica antirreflujo de elección es la funduplicatura parcial tipo Toupet, con cuatro puntos simples a cada lado entre el margen de la miotomía y el fundus gástrico y el primero de los cuales también se fija al pilar diafragmático ipsilateral. En caso de necesidad, por ejemplo, si hay dudas sobre la integridad de la mucosa, se realiza funduplicatura parcial tipo Dor. Se deja un drenaje aspirativo.
Análisis estadísticoSe llevó a cabo un análisis descriptivo de los datos, que se expresan como porcentajes en el caso de las variables categóricas y como media±desviación estándar en el de las variables continuas.
ResultadosLa muestra está formada por 45 pacientes, 25 hombres y 20 mujeres, con edad media de 44 años (rango 20 - 65 años). La mayoría de los pacientes presentaba un índice de masa corporal dentro del intervalo normal (68,9% <24,9kg/m2) y un riesgo anestésico grado II (64,5%) según la clasificación de la American Society of Anesthesiologists. Ningún paciente tenía antecedentes de cirugía abdominal supramesocólica.
El tiempo de clínica hasta el diagnóstico fue de menos de 5 años en el 82,2% de los pacientes. Preoperatoriamente el Eckardt score medio era 4,26. El síntoma principal al diagnóstico era la disfagia (93,3% de los pacientes) y aparecía a diario (42,2%) o incluso con cada comida (31,1%). Veinticuatro pacientes (53,3%) presentaban pérdida de peso, siendo de> 10kg en 10 casos. Otros síntomas frecuentes fueron el dolor torácico y la regurgitación (33,3% ambos). En 2 de los 12 pacientes que disponían de una pH-metría preoperatoria se detectó reflujo gastroesofágico patológico (índice de DeMeester> 14,7).
La media de la presión del esfínter esofágico inferior en reposo era 27,25mmHg y la de la presión residual tras la deglución 12,05mmHg, con un índice de relajación medio de 56,35%. A nivel del cuerpo esofágico la manometría evidenciaba aperistalsis, excepto en 3 casos correspondientes a acalasia vigorosa en los que se detectaban ondas hipertensivas.
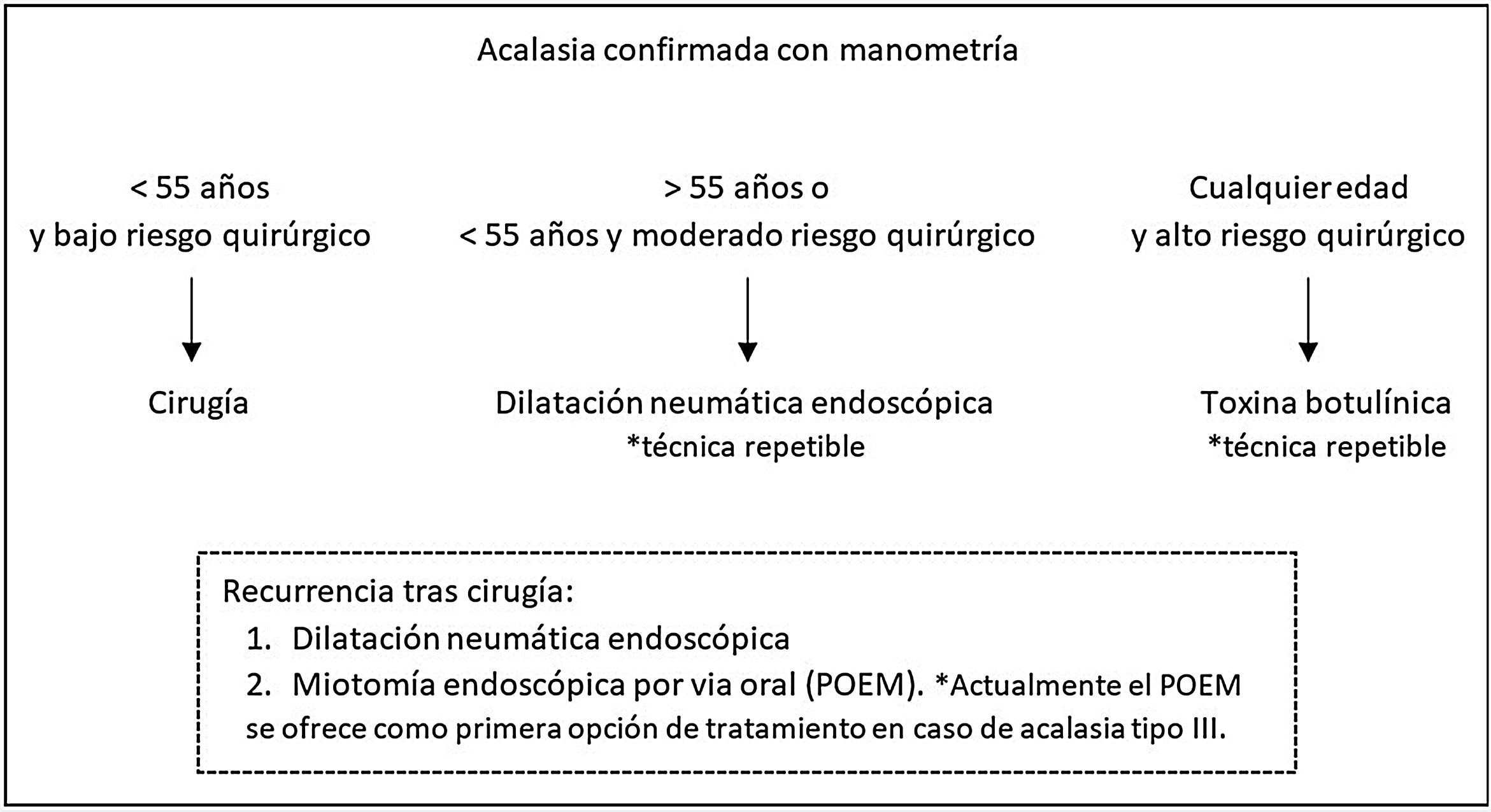
Diecinueve pacientes (42,2%) habían recibido tratamiento endoscópico previo a la cirugía, 14 (73,7%) se sometieron a dilatación neumática, 3 (15,8%) recibieron inyección de toxina botulínica y 2 (10,5%) recibieron ambos tratamientos. De los 16 pacientes sometidos a dilatación neumática, 12 (75%) habían requerido 2 o más sesiones. En la figura 2 se presenta el algoritmo de tratamiento usado en nuestro centro. En los pacientes de la serie que recibieron toxina botulínica, esta se indicó como terapia puente a la cirugía en contexto de necesidad de ingreso por disfagia absoluta.
Resultados operatorios y curso postoperatorioLa técnica quirúrgica empleada fue la miotomía de Heller asociada a funduplicatura parcial tipo Toupet, excepto en 2 casos en los que se asoció funduplicatura parcial tipo Dor, debido a íntimo contacto entre estómago y bazo en un paciente y a dificultad en la disección por importante fibrosis en relación con dilataciones previas en otro. No hubo perforaciones intraoperatorias ni necesidad de conversión a cirugía abierta.
El tiempo operatorio medio fue de 211 min, incluyendo el tiempo de acoplamiento del robot. En los 8 primeros casos de la serie se practicó endoscopia intraoperatoria para evaluar que la miotomía fuera completa, así como posibles perforaciones, ascendiendo el tiempo operatorio medio a 294 min frente a 193 min (rango 122-290) en el resto de casos. En los pacientes sometidos a dilatación neumática previa cirugía el tiempo operatorio medio solo se veía aumentado en 2 min.
La estancia hospitalaria media fue 5 días (rango 3-17 días), con el 62,2% de los pacientes siendo dados de alta dentro de los primeros 4 días.
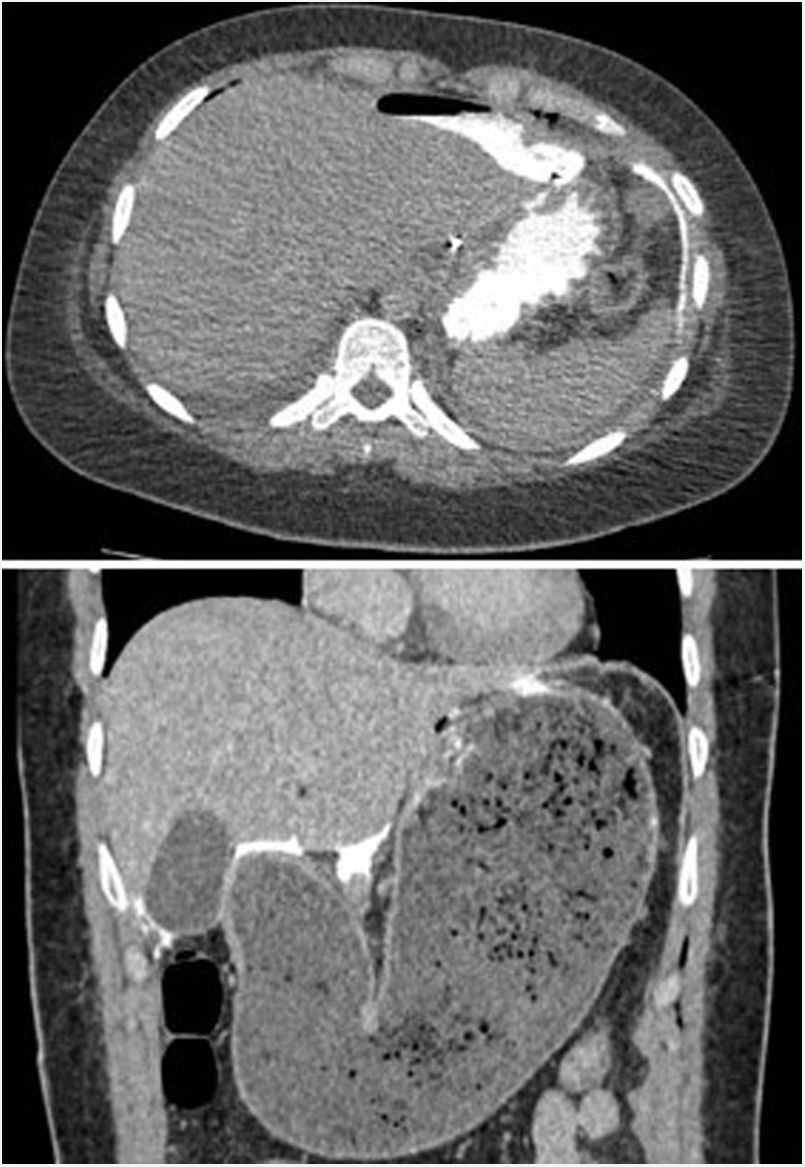
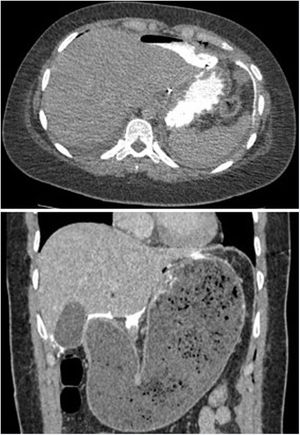
Hubo dos perforaciones postoperatorias (4,4%); una al tercer día en una paciente con síndrome de Allgrove (insuficiencia adrenal congénita, acalasia y alacrimia) y otra al cuarto día en un paciente que había sido dado de alta al tercer día con una prueba de imagen sin fugas y correcta tolerancia oral, y que tras trasgresión diétetica consultó a urgencias por vómitos y dolor abdominal con evidencia de gastroparesia y fuga de contraste oral en el escáner urgente (fig. 3). Ambos se reintervinieron mediante laparotomía media evidenciándose la perforación en la vertiente gástrica de la miotomía y se realizó sutura primaria del defecto y colocación de drenajes, con buena evolución postoperatoria. La paciente con síndrome triple A presentó una crisis comicial parcial en el postoperatorio de la reintervención. Otra complicación menor fue la retención aguda de orina, que presentaron 3 pacientes. La mortalidad peroperatoria fue del 0%.
Los datos operatorios y postoperatorios se recogen en la tabla 1.
Datos operatorios y postoperatorios (n=45)
| Estancia hospitalaria (días)X•±s (rango) | 5±3 (3 - 17) |
| Técnica quirúrgica n (%)Miotomía+funduplicatura- De Toupet- De Dor | 43 (95,6)2 (4,4) |
| Tiempo quirúrgico (min)X•±s | 211,75±60,17 |
| Conversión a cirugía abierta n (%) | 0 (0) |
| Perforación intraoperatoria n (%) | 0 (0) |
| Perforación postoperatoria n (%) | 2 (4,4) |
| Reintervención n (%) | 2 (4,4) |
| Mortalidad peroperatoria n (%) | 0 (0) |
El seguimiento medio fue de 64 meses (s±34). Se han excluido 8 pacientes; 7 se perdieron y uno murió por causas desconocidas a los 32 meses de seguimiento. De los 37 restantes, 10 han llegado a los 3 años de seguimiento, 19 a los 5 años y 2 a los 10 años.
Al cierre de seguimiento, el 94,6% de los pacientes presentaban resolución de los síntomas. Vemos una importante disminución del Eckardt score a los 3 y 5 años respecto al preoperatorio, hasta valores de 0,5 y 1, respectivamente (tabla 2).
Resultados clínicos y manométricos (n=37)
| Preoperatorio | Postoperatorio | ||
|---|---|---|---|
| 3 años | 5 años | ||
| Eckardt scoreX•±s | 4,26±2,51 | 0,5±0,77 | 1±1,85 |
| Presión de reposo media EEI (mmHg)X•±sPresión residual EEI (mmHg) X•±sÍndice de relajación (%) X•±s | 27,16±10,8112,06±7,7656,35±29,04 | 11,32±6,026,56±3,2659,76±14,41 | 8,07±3,675,45±3,7062,54±20,49 |
EEI:esfínter esofágico inferior.
Los resultados manométricos postoperatorios estaban disponibles en 14 pacientes a los 3 años y en 14 a los 5 años (tabla 2). Se evidencia una reducción tanto de la presión media de reposo (del 58 y del 70% a los 3 y a los 5 años, respectivamente) como de la presión media residual (del 45 y del 54% a los 3 y a los 5 años, respectivamente), así como un aumento del índice de relajación. En todos los pacientes persiste aperistalsis del cuerpo esofágico. Todavía no se dispone de exploraciones complementarias de control a 10 años de seguimiento.
En las endoscopias de seguimiento, realizadas en 25 pacientes a los 3 años y en 14 a los 5 años, se han detectado 7 casos de esofagitis. Hay dos casos (5,4%) de reflujo gastroesfágico patológico demostrado por pH-metría. En ausencia de síntomas y pH-metría normal se retiran los inhibidores de la bomba de protones.
Ha habido 4 casos (10,8%) de recurrencia: dos al año de la cirugía, uno a los dos años y otro a los seis años. El diagnóstico ha sido clínico en los 4 casos, de los cuales 2 también disponen de manometría. Todos se han sometido a tratamiento con dilatación neumática endoscópica con buena evolución posterior en dos casos tras 2 y 3 dilataciones, respectivamente. Los 2 casos restantes están pendientes de valorar la realización de miotomía endoscópica por vía oral como tratamiento de rescate.
DiscusiónEl tratamiento de la acalasia busca paliar los síntomas derivados de la ausencia de relajación del esfínter esofágico inferior (EEI) disminuyendo la presión a nivel del mismo, facilitando así el paso del alimento desde el esófago hacia el estómago. Frente a los demás tratamientos, la cirugía consigue los resultados más duraderos3,5,13 a la vez que trata el reflujo gastroesofágico que frecuentemente aparece en estos pacientes debido a la disrupción del EEI8,16. La miotomía de Heller asociada a funduplicatura parcial es la técnica quirúrgica de elección. Desde su introducción a principios de los 90, el abordaje laparoscópico se ha considerado el gold standard, al demostrarse eficaz y seguro a la vez que aportaba una menor morbilidad, una estancia hospitalaria más corta y menos dolor frente a la cirugía abierta2,10,13. No obstante, el porcentaje de perforaciones esofágicas y la recurrencia de los síntomas se mantenían elevados e incluso comparables a los de la técnica abierta3,5. En 2001 Melvin et al. describen el abordaje robótico para el tratamiento de la acalasia14, y en las series publicadas a lo largo de estos años se presenta como una opción comparable, sino mejor, a la laparoscopia5–10,15. Kim et al. describen una tendencia a un mejor resultado clínico y a una menor recurrencia en el grupo asistido por robot respecto al grupo laparoscópico en relación con una miotomía más larga y completa hacia el estómago gracias a la mejor visualización y mayor amplitud de movimientos ofrecidos por el robot7, que a su vez, hacen al procedimiento robótico más seguro, lo que se traduce en un menor porcentaje de perforaciones intraoperatorias3,17, y, en caso de haberlas, menos conversión a cirugía abierta para su reparación5. La principal desventaja de la tecnología robótica es su coste, aunque en hospitales en los que se comparte por varias especialidades esta se mitiga8 y probablemente se reducirá con el tiempo, como el de la laparoscopia10,17. Aun así, se necesitan ensayos clínicos prospectivos randomizados en series largas de pacientes para dar conclusiones definitivas sobre cuál es el mejor abordaje quirúrgico para el tratamiento de la acalasia3,9.
Desde su introducción en 2010 en nuestro centro, la cirugía robótica se ha usado en el tratamiento de los pacientes con acalasia mediante realización de miotomía de Heller asociada a funduplicatura parcial tipo Toupet. Se prefiere la funduplicatura posterior a la anterior porque se considera que ayuda a mantener los márgenes de la miotomía abiertos y se produce menos fibrosis en esta zona. La funduplicatura parcial tipo Dor se usa en caso de necesidad, ya sea por aspectos técnicos o si hay dudas sobre la integridad de la mucosa. En nuestra serie no se produjeron perforaciones intraoperatorias, pero hubo dos en el postoperatorio (4,4%) localizadas en la vertiente gástrica de la miotomía y en pacientes sometidos a dilataciones neumáticas previas a la cirugía. Horgan et al. describen que las perforaciones son más frecuentes a nivel de la unión esofagogástrica y en el estómago proximal probablemente debido a la mayor dificultad en el desarrollo del plano submucoso por el cambio de dirección de las fibras musculares del esófago al estómago y por una mayor tendencia al sangrado en estas zonas5. Asimismo, refieren que otros factores y no solo las dilataciones previas, parecen estar en relación con la frecuencia de esta complicación5. Cuatro pacientes de la serie (10,8%) presentaron recurrencia de los síntomas. En todos ellos se realizaron varias dilataciones con balón siendo exitosas en dos casos, mientras que los dos restantes están pendientes de valorar la realización de miotomía endoscópica por vía oral (POEM), que en nuestro centro tendría su principal indicación como tratamiento de la recidiva tras miotomía robótica. En la guía clínica de 2018 de la International Society for Diseases of the Esophagus se recomienda la dilatación neumática como primera opción de tratamiento tras miotomía fallida y se considera al POEM como un tratamiento apropiado para la recurrencia después de miotomía laparoscópica16. El robot también podría tener su aplicación en la reintervención por miotomía laparoscópica incompleta7.
El POEM se ha mostrado como una técnica eficaz y segura a corto y medio plazo17,18, superior a la miotomía laparoscópica15 especialmente en el tratamiento de la acalasia tipo III al permitir una mayor extensión de la miotomía proximalmente hacia el esófago torácico espástico19. Nuestro grupo considera que el robot también es adecuado en este escenario. Kashab et al. describen miotomías significativamente más largas mediante POEM que por robot (11,6cm vs. 8,6cm, P <0,0001), pero con igual eficacia y seguridad para ambas técnicas20. El principal inconveniente del POEM frente a la cirugía es la elevada incidencia de reflujo gastroesofágico y esofagitis que asocia17,18. Para resolver esto, Ione et al. presentaron un estudio piloto con 21 pacientes en el que se añadía una funduplicatura endoscópica al POEM estándar21. ¿Acabará el POEM por sustituir a la cirugía? Se necesitarán estudios randomizados que comparen efectividad a largo plazo de POEM, miotomía de Heller laparoscópica y robótica para dilucidarlo.
Los pacientes con acalasia requieren un seguimiento a largo plazo; un éxito temprano tras el tratamiento no indica que este resultado se vaya a mantener en el tiempo6. En nuestro centro se propone seguimiento con estudio manométrico, endoscópico y pH-metría a los 3, a los 5 y a los 10 años con el objetivo de validar de forma objetiva los resultados a largo plazo de la implementación de la miotomía robótica. Se trata de pacientes con un desorden crónico en el que no se logra restaurar el trastorno motor del cuerpo esofágico, por lo que no solo debemos valorar la posibilidad de reflujo gastroesofágico patológico sino de síntomas causados por la estasis de material en el esófago distal6. No hay que olvidar, que los pacientes con acalasia acarrean un riesgo incrementado de desarrollar un cáncer escamoso de esófago 10 años o más desde el tratamiento16.
ConclusionesSegún nuestra experiencia, el abordaje robótico en el tratamiento de la acalasia es seguro y efectivo. La miotomía endoscópica se reserva para los casos de recidiva tras tratamiento quirúrgico que no mejoran con dilatación neumática.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.