El objetivo de nuestro estudio fue investigar la presencia, las características clínicas y los factores de riesgo para la adquisición de infección urinaria febril/pielonefritis (ITU/PNA) de la comunidad por microorganismos productores de betalactamasas de espectro extendido (BLEE+) en niños <2años que fueron ingresados en el hospital.
MétodosEstudio de casos-controles en un hospital de segundo nivel en España. Se revisaron de forma retrospectiva 537 episodios de ITU/PNA entre noviembre de 2005 y agosto de 2014. Los casos fueron las ITU/PNA BLEE+. Por cada caso se escogieron 4 controles betalactamasas de espectro extendido negativos (BLEE−). Para cada paciente se rellenó un cuestionario con las variables de interés y se realizó la comparación entre los grupos.
ResultadosSe identificaron 19 casos (3,5%) BLEE+. De ellos, 16 (84%) fueron Escherichia coli. El reflujo vesicoureteral (RVU) de cualquier grado fue más frecuente en el grupo BLEE+ (60 vs. 29%), aunque la diferencia no alcanzó significación estadística. Las recurrencias fueron más frecuentes en el grupo BLEE+ (42% vs 18%) (p=0,029; OR=3,2; IC−95%: 1,09-9,5). La prevalencia de ITU/PNA BLEE+ se incrementó ligeramente desde el 2,7% en el periodo 2005-2009 al 4,4% en el periodo 2010-2014.
ConclusionesLas ITU/PNA BLEE+ se asociaron a recurrencias más frecuentes. El RVU fue el doble de frecuente en el grupo BLEE+. Piperacilina/tazobactam, meropenem y fosfomicina mostraron una excelente actividad. Los aminoglucósidos pueden ser una opción terapéutica, y en nuestra serie la gentamicina fue el antibiótico más utilizado.
Extended-spectrum beta-lactamase (ESBL) producing bacteria are infrequent pathogens of urinary tract infections in children. The objective of our study was to investigate the presence, clinically associated characteristics and risk factors for acquisition of urinary tract infection/acute pyelonephritis (UTI/APN) in hospitalised children <2years old caused by community-acquired ESBL.
MethodsA case-control study in a second level community hospital in Spain, in which 537 episodes of UTI/APN were investigated in a retrospective study between November 2005 and August 2014. Cases were patients with ESBL strains. For each case, four ESBL-negative controls were selected. A questionnaire with the variables of interest was completed for every patient, and the groups were compared.
ResultsESBL-positive strains were found in 19 (3,5%) cultures. Of these 16 (84%) were Escherichia coli. Vesicoureteral reflux (VUR) of any grade was more frequent in the ESBL group (60 vs. 29%), although without statistical significance. Relapses were more frequent in the ESBL group (42% vs. 18%) (P=.029; OR=3.2; 95%CI: 1.09-9.5). The prevalence of UTI/APN due to ESBL-positive strains increased slightly from 2.7% in the period 2005-2009 to 4.4% in the period 2010-2014.
ConclusionsESBL UTI/APN were associated with more frequent relapses. VUR of any grade was twice more frequent in the ESBL group. Piperacillin/tazobactam, fosfomycin and meropenem showed an excellent activity. Aminoglycosides may be a therapeutic option, and in our patients gentamicin was the antibiotic most used.
Las betalactamasas de espectro extendido (BLEE) son un grupo de enzimas de codificación plasmídica producidas principalmente por enterobacterias; su espectro hidrolítico incluye a las amino-, carboxi- y ureidopenicilinas, monobactámicos y cefalosporinas de primera, segunda, tercera y cuarta generación1-3 con excepción de las cefamicinas. No hidrolizan las carbapenemas ni las combinaciones de betalactámicos con inhibidores de betalactamasas como el ácido clavulánico, tazobactam y sulbactam4. Es frecuente que estos aislados sean portadores de genes que codifican resistencia a otros antimicrobianos1,3,5.
Aunque los microorganismos productores de BLEE (BLEE+) emergieron como causa de infección nosocomial en los hospitales, las infecciones en la comunidad (especialmente las urinarias) se han convertido en un problema en la práctica clínica cuya incidencia está aumentando1,5-12. La prevalencia y distribución de microorganismos BLEE+ como causa de ITU febril/pielonefritis (ITU/PNA) adquirida en la comunidad en niños no es bien conocida y resulta preocupante por la resistencia de estos aislados a muchos betalactámicos y otros antimicrobianos13. El conocimiento de los factores de riesgo para estas infecciones puede ser de utilidad para la identificación de pacientes de alto riesgo y administrar así un tratamiento empírico con más probabilidades de ser efectivo8. No hemos encontrado estudios en España sobre la prevalencia y los factores de riesgo de ITU/PNA por bacterias BLEE+ en niños. El objetivo de nuestro estudio fue conocer las características clinicoanalíticas, la sensibilidad antibiótica y los factores de riesgo para ITU/PNA por bacterias BLEE+ en niños frente a las producidas por microorganismos no productores de BLEE (BLEE−).
MétodosSe trata de un estudio retrospectivo descriptivo y analítico de casos-controles. Los casos fueron los episodios de ITU/PNA adquiridos en la comunidad producidos por microorganismos BLEE+ en niños menores de 24 meses previamente sanos en su primer episodio de hospitalización desde noviembre de 2005 hasta agosto de 2014. Se escogió este grupo de edad porque corresponde a la mayoría de los episodios de ITU/PNA que han sido ingresados durante el periodo de estudio y en los que el ingreso y el seguimiento en consultas externas proporcionaba un registro adecuado de las variables de interés.
El estudio se realizó en el Hospital Universitario Doctor Peset de Valencia, que es un hospital de segundo nivel que atiende una población aproximadamente de 50.000 niños. Se revisaron 636 episodios sospechosos de ITU/PNA obtenidos de las bases de datos del hospital. De la revisión se excluyeron las recurrencias incluyendo únicamente el primer episodio de ITU/PNA, los pacientes con muestras de orina contaminadas, aquellos en los que el urinocultivo resultó negativo, aquellos en los que el antibiograma no estaba disponible en la base de datos del hospital y los casos en los que el resultado del urinocultivo no se pudo conocer porque se había realizado en otro hospital al que no se pudo tener acceso.
Los criterios diagnósticos de ITU dependieron del método de recogida de la orina de acuerdo a las recomendaciones de las Guías de ITU de la Asociación Española de Pediatría14,15. No se permitió la recogida de orina para cultivo por bolsita colectora.
Se definieron los episodios de ITU/PNA adquiridos en la comunidad como aquellos con urinocultivo positivo identificados en la Unidad de Urgencias del hospital o en las primeras 48h del ingreso hospitalario. Por cada caso de ITU/PNA producidos por microorganismos BLEE+ se escogieron 4 controles producidos por aislados BLEE− por vecindad temporal, los 2 anteriores y los 2 posteriores al caso, que cursaron con ingreso hospitalario.
El tratamiento empírico guiado por la visualización de bacilos gramnegativos en la tinción de Gram de la muestra de orina se realizó con gentamicina. La identificación de los aislamientos BLEE+ y el estudio de la sensibilidad antibiótica fueron realizados por el Laboratorio de Microbiología Clínica siguiendo las recomendaciones de los Clinical and Laboratory Standards Institute16. Para la confirmación de las BLEE se utilizó la técnica de doble difusión colocando discos de cefalosporinas (cefotaxima, ceftazidima, cefuroxima) y aztreonam alrededor de otro disco de amoxicilina-clavulánico. La presencia de BLEE se manifestó por un efecto sinérgico inhibidor de ampliación del halo de uno o varios betalactámicos.
Mediante una encuesta estructurada se recogieron de la historia clínica de los niños las siguientes variables: sexo, edad, intensidad de la fiebre máxima, horas de evolución del cuadro antes del ingreso, recuento leucocitario, recuento de neutrófilos, valores de proteína C reactiva (PCR) expresada en mg/l, valores de procalcitonina (PCT) en ng/ml, identificación microbiológica del aislado, antibiograma, resultado de la ecografía renal, de la gammagrafía con ácido dimercaptosuccínico (DMSA) y de la cistouretrografía miccional seriada (CUMS) en los casos en que se realizó, número de recurrencias e indicación de quimioprofilaxis al alta del ingreso.
Para el análisis estadístico se utilizó la prueba de chi cuadrado para la comparación de proporciones en variables cualitativas, la prueba de t de Student para la comparación de 2 variables paramétricas y la U de Mann-Whitney para la comparación de 2 variables no paramétricas. Para el análisis estadístico se utilizó el programa SPSS (v.22) con licencia de la Universitat de València. Se consideró significativo un valor de p≤0,05.
ResultadosDe los 636 casos estudiados, se excluyeron 99 (fig. 1), por lo que se analizó una población final de 537 niños. Se identificaron 19 aislados BLEE+ (3,5%; IC95%: 2,1-5,5%). Entre los 95 episodios estudiados (19 casos y 76 controles) los microorganismos aislados fueron Escherichia coli en 84 casos (88,4%), Klebsiella pneumoniae en 4 (4,2%), Citrobacter spp. en 3 (3,3%), Proteus mirabilis en uno (1,1%), Morganella morganii en uno (1,1%), Enterobacter cloacae en uno (1,8%). De los 19 aislados BLEE+, 16 (84,2%) fueron E. coli, uno (5,3%) K. pneumoniae, uno (5,3%) Morganella morganii y uno (5,3%) Citrobacter spp. No se observó diferencia en la frecuencia de aislamiento de Klebsiella spp. entre el grupo BLEE+ (5%) y BLEE− (4%).
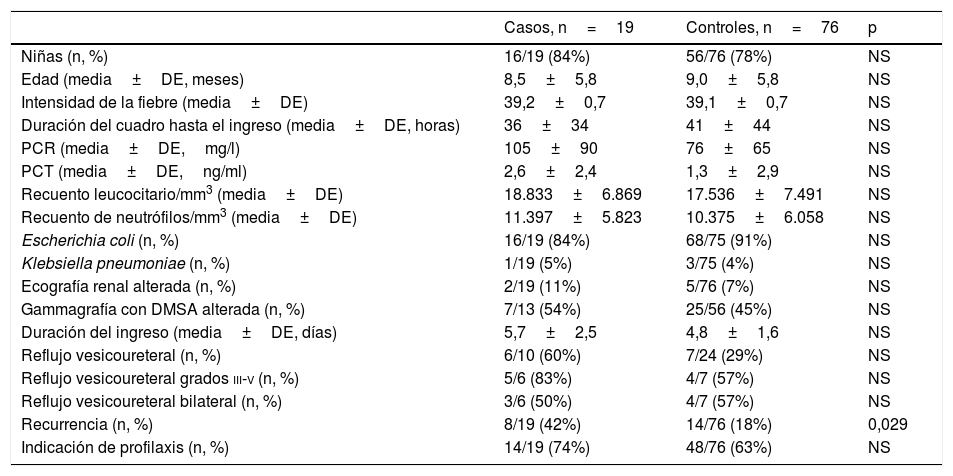
El grupo de casos y el de controles eran comparables en cuanto a la distribución por sexo, edad y horas transcurridas desde el comienzo del cuadro hasta el ingreso hospitalario (tabla 1). No hubo diferencia en la intensidad de la fiebre máxima. No se observaron diferencias en el recuento leucocitario, de neutrófilos ni en la duración del ingreso hospitalario. La diferencia entre la media del valor de la PCR de los casos (105mg/l) y de los controles (76mg/l) y entre la media del valor de la PCT en los casos (2,6ng/ml) frente a los controles (1,3ng/ml) no alcanzó significación estadística.
Características de casos y controles
| Casos, n=19 | Controles, n=76 | p | |
|---|---|---|---|
| Niñas (n, %) | 16/19 (84%) | 56/76 (78%) | NS |
| Edad (media±DE, meses) | 8,5±5,8 | 9,0±5,8 | NS |
| Intensidad de la fiebre (media±DE) | 39,2±0,7 | 39,1±0,7 | NS |
| Duración del cuadro hasta el ingreso (media±DE, horas) | 36±34 | 41±44 | NS |
| PCR (media±DE,mg/l) | 105±90 | 76±65 | NS |
| PCT (media±DE,ng/ml) | 2,6±2,4 | 1,3±2,9 | NS |
| Recuento leucocitario/mm3 (media±DE) | 18.833±6.869 | 17.536±7.491 | NS |
| Recuento de neutrófilos/mm3 (media±DE) | 11.397±5.823 | 10.375±6.058 | NS |
| Escherichia coli (n, %) | 16/19 (84%) | 68/75 (91%) | NS |
| Klebsiella pneumoniae (n, %) | 1/19 (5%) | 3/75 (4%) | NS |
| Ecografía renal alterada (n, %) | 2/19 (11%) | 5/76 (7%) | NS |
| Gammagrafía con DMSA alterada (n, %) | 7/13 (54%) | 25/56 (45%) | NS |
| Duración del ingreso (media±DE, días) | 5,7±2,5 | 4,8±1,6 | NS |
| Reflujo vesicoureteral (n, %) | 6/10 (60%) | 7/24 (29%) | NS |
| Reflujo vesicoureteral grados iii-v (n, %) | 5/6 (83%) | 4/7 (57%) | NS |
| Reflujo vesicoureteral bilateral (n, %) | 3/6 (50%) | 4/7 (57%) | NS |
| Recurrencia (n, %) | 8/19 (42%) | 14/76 (18%) | 0,029 |
| Indicación de profilaxis (n, %) | 14/19 (74%) | 48/76 (63%) | NS |
DE: desviación estándar; DMSA: ácido dimercaptosuccínico; NS: no significativo; PCR: proteína C reactiva; PCT: procalcitonina.
El porcentaje de anomalías en la ecografía renal entre los casos fue del 11%, y del 7% entre los controles. La gammagrafía renal con DMSA resultó alterada en el 54% de los casos y en el 45% de los controles en los que se realizó esta prueba. Cuando se realizó una CUMS, se encontró reflujo vesicoureteral (RVU) en el 60% de los casos y en el 29% de los controles, y entre ellos, la proporción de RVU gradoiii-v fue del 83% entre los casos y del 57% en los controles. Sin embargo, ninguna de estas diferencias alcanzó significación estadística. La proporción de recurrencias entre los casos (42%) fue mucho mayor que entre los controles (18%) (p=0,029; OR=3,2; IC95%: 1,1-9,5), con 2 o más recurrencias en el 26% en el grupo BLEE+ frente al 3% en el grupo BLEE− (p<0,01; OR=13,1; IC95%: 2,3-76,9).
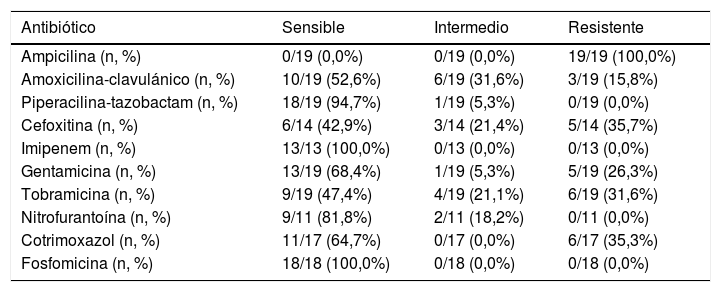
Todos los aislados BLEE+ fueron resistentes a ampicilina, el 16% a amoxicilina-clavulánico, el 36% a cefoxitina, el 26% a gentamicina, el 32% a tobramicina y el 35% a cotrimoxazol (tabla 2). Casi el 70% de los aislados BLEE+ fueron sensibles al tratamiento empírico con gentamicina. No hubo resistencias a fosfomicina, piperacilina-tazobactam ni meropenem. Se produjo un episodio de bacteriemia por E. coli en el grupo BLEE+. No se registraron otras complicaciones (como nefronia/absceso renal) ni mortalidad asociada a los episodios BLEE+. No hubo diferencia entre casos y controles en la indicación de quimioprofilaxis al alta de la hospitalización. La incidencia anual de casos de ITU/PNA por bacterias BLEE+ se muestra en la figura 2. Al agrupar los años estudiados, en el periodo 2005-2009 el porcentaje de aislados BLEE+ fue del 2,7%, mientras que en el periodo 2010-2014 fue del 4,4%, aunque este incremento no alcanzó significación estadística.
Sensibilidad antimicrobiana de los aislados BLEE+
| Antibiótico | Sensible | Intermedio | Resistente |
|---|---|---|---|
| Ampicilina (n, %) | 0/19 (0,0%) | 0/19 (0,0%) | 19/19 (100,0%) |
| Amoxicilina-clavulánico (n, %) | 10/19 (52,6%) | 6/19 (31,6%) | 3/19 (15,8%) |
| Piperacilina-tazobactam (n, %) | 18/19 (94,7%) | 1/19 (5,3%) | 0/19 (0,0%) |
| Cefoxitina (n, %) | 6/14 (42,9%) | 3/14 (21,4%) | 5/14 (35,7%) |
| Imipenem (n, %) | 13/13 (100,0%) | 0/13 (0,0%) | 0/13 (0,0%) |
| Gentamicina (n, %) | 13/19 (68,4%) | 1/19 (5,3%) | 5/19 (26,3%) |
| Tobramicina (n, %) | 9/19 (47,4%) | 4/19 (21,1%) | 6/19 (31,6%) |
| Nitrofurantoína (n, %) | 9/11 (81,8%) | 2/11 (18,2%) | 0/11 (0,0%) |
| Cotrimoxazol (n, %) | 11/17 (64,7%) | 0/17 (0,0%) | 6/17 (35,3%) |
| Fosfomicina (n, %) | 18/18 (100,0%) | 0/18 (0,0%) | 0/18 (0,0%) |
En nuestro país el interés por las bacterias BLEE+ en los últimos 20años ha sido creciente. La prevalencia de estas bacterias en niños es menos conocida que en adultos. Solo una publicación reciente en el País Vasco13 muestra una prevalencia de portadores de E. coli BLEE+ en heces del 24% de 125 niños de 8 a 16 meses de edad. El origen de estos aislados podría estar en el abuso del empleo de antibióticos en humanos y animales, infecciones cruzadas entre humanos o la transmisión desde mascotas u otros animales contaminados al hombre a través de la cadena alimentaria17,18.
En nuestro estudio los aislados BLEE+ fueron una causa poco frecuente (3,5%) de ITU/PNA en niños menores de 2años hospitalizados. En países del entorno mediterráneo un estudio realizado en Grecia encontró una incidencia del 10,4% de las ITU en niños menores de 14años19, otro en Israel del 5% en las ITU en menores de 18años9 y otro en Turquía, también en niños, del 43%20.
La intensidad máxima de la fiebre, las horas de evolución del cuadro y las variables hematológicas como recuento de leucocitos y de neutrófilos no fueron diferentes entre los 2 grupos, como ocurrió en otros estudios8,9,11,20. Los reactantes de fase aguda (PCR y PCT) no fueron significativamente más elevados en los casos BLEE+ frente a los controles, como tampoco lo fue la proporción de lesión aguda en la gammagrafía renal con DMSA.
En cuanto a los factores de riesgo para ITU/PNA, la ecografía renal estuvo discretamente más alterada en los casos (11% vs 7%) que en los controles. La presencia de RVU de cualquier grado fue el doble entre los casos frente a los controles (60% vs 29%), el RVU de alto grado (83% vs 57%) y la indicación de profilaxis (74% vs 63%) fueron mayores en el grupo BLEE+ aunque sin significación estadística. Solo la mayor proporción de recidivas alcanzó significación estadística (42% vs 18%), como ocurrió en otros estudios en niños8,10,11,20. Cuatro estudios en niños encontraron que anomalías anatómicas y funcionales de las vías urinarias como el RVU eran factores de riesgo para infecciones BLEE+8,9,11,21. Un estudio encontró mayor proporción de anomalías anatómicas y funcionales, pero no mayor proporción de reflujo19. En base a todo ello, el aislamiento de bacterias BLEE+ podría considerarse como un posible indicador de anomalías nefrourológicas, especialmente RVU de alto grado.
El empleo de cefalosporinas y otros antibióticos en los 1-3meses previos se ha identificado como factor de riesgo en varios estudios6,8-11,19,20,22 y creemos oportuno señalar que para evitar la selección de microorganismos BLEE+ debería evitarse el empleo de cefalosporinas como profilaxis20. Dado el carácter retrospectivo de nuestro estudio, el uso previo de antibióticos no pudo ser analizado. La hospitalización reciente o las enfermedades de base (metabólicas, oncohematológicas, etc.), identificadas como factores de riesgo en otros estudios9-11,20, no fueron analizadas al incluir como casos el primer episodio de hospitalización por ITU/PNA en niños previamente sanos.
En algunos estudios se ha encontrado una mayor frecuencia relativa de aislamiento de Klebsiella spp. en el grupo BLEE+ y se ha propuesto que la identificación de Klebsiella podría ser un predictor de posible aislamiento de microorganismo BLEE+8,9,19,22; sin embargo, esto no ocurrió en nuestro estudio.
Los microorganismos BLEE+ codifican resistencia para cefalosporinas de tercera generación que son el tratamiento de elección en ITU/PNA en niños no hospitalizados y son una opción de tratamiento empírico en niños ingresados14,15. Esto puede suponer un manejo antibiótico inapropiado antes de disponer del resultado del urinocultivo20. Tras iniciar un tratamiento empírico con cefalosporinas de tercera generación es recomendable vigilar la respuesta clínica, que si es desfavorable, puede ser un indicador precoz de etiología por bacterias BLEE+.
Estos aislados muestran resistencia cruzada con otros antibióticos no betalactámicos23. Cuatro de los 19 aislados (21%) de nuestro estudio mostraron resistencia a 2 o más antibióticos no betalactámicos. Todo ello suele suponer la necesidad de hospitalización para el tratamiento20 y, dado el perfil de multirresistencia, las opciones de tratamiento pueden ser limitadas. En nuestro estudio fosfomicina, piperacilina-tazobactam y meropenem mostraron una excelente actividad, como en otros estudios6,24, aunque destaca el elevado porcentaje de cepas resistentes e intermedias a cefoxitina, lo que puede ser indicio de la presencia de cefamicinasas plasmídicas de tipo AmpC.
Hay pocos datos en la literatura para hacer recomendaciones sobre el tratamiento de estas infecciones en niños. Para el tratamiento de infecciones BLEE+, Curello y MacDougall5 proponen como primera opción en pacientes con shock séptico o inmunocomprometidos y en pacientes clínicamente estables con pielonefritis una carbapenema. Para evitar el uso de carbapenemas y la emergencia de resistencias, Park et al.25 sugieren para el tratamiento de la pielonefritis aguda de la comunidad en adultos el uso de aminoglucósidos, fluorquinolonas y de combinaciones de un betalactámico/inhibidor de betalactamasa (especialmente piperacilina/tazobactam y en bastante menor grado amoxicilina/clavulánico por la claramente mayor proporción de resistencias2). En su revisión comunican que los aminoglucósidos fueron los antibióticos no carbapenémicos más utilizados en pacientes con pielonefritis no complicadas que tenían poca o ninguna comorbilidad, y no observaron fallos clínicos o microbiológicos25.
El inconveniente de la piperacilina/tazobactam es que en ficha técnica su empleo está aprobado en mayores de 2años26 y su utilidad puede afectarse por el efecto inóculo (aumento considerable de la CMI en presencia de inóculos bacterianos elevados)7. Las cefamicinas desarrollan fácilmente resistencias y no se recomiendan23. El empleo de quinolonas no está autorizado en menores de 18años, aunque se han usado sin efectos secundarios relevantes en infecciones multirresistentes27.
Por todo ello, los aminoglucósidos pueden ser una opción de tratamiento empírico28 y definitivo en las ITU/PNA de niños, favorecido por sus altas concentraciones en tejido renal y condicionado al perfil de resistencias locales en aislados BLEE+ y la sensibilidad del aislado en cada caso. En nuestra serie la gentamicina fue el antimicrobiano más utilizado al ser el tratamiento empírico de elección al que casi el 70% de aislados BLEE+ fueron sensibles. Esto podría contribuir a explicar la falta de diferencias en la gravedad de la lesión en la gammagrafía con DMSA, ya que en muchos casos no hubo demora en iniciar un tratamiento eficaz. Sin embargo, el porcentaje de resistencia a gentamicina fue del 26%, lo que obliga a vigilar la sensibilidad de estos aislados en el antibiograma. La amikacina es el aminoglucósido menos afectado por las resistencias en microorganismos BLEE+7,23,24, aunque en nuestro estudio no disponemos de datos de sensibilidad a amikacina.
La fosfomicina no posee resistencia cruzada con otros antibióticos29. En la revisión de Falagas et al.30 el 96,8% de 1.657 aislados de E. coli BLEE+ y el 81,3% de 748K.pneumoniae BLEE+ fueron sensibles a fosfomicina. Su empleo parece cada vez más frecuente en estos casos. Sin embargo, la experiencia en el empleo de fosfomicina en infecciones graves del tracto urinario en niños es limitada, y cuando hay sospecha de afectación renal o sistémica debe usarse por vía intravenosa, quedando la vía oral para infecciones urinarias bajas no complicadas29.
Todo lo comentado limita mucho las opciones de tratamiento por vía oral al alta de la hospitalización, lo que puede prolongar la estancia hospitalaria9-11,19. En nuestra serie la media de duración del ingreso de los casos fue solo un día mayor al de los controles, lo que atribuimos a que casi el 70% de los aislados BLEE+ fueron sensibles al tratamiento inicial con gentamicina y a que se dispuso de alternativa oral para el alta hospitalaria en 8 casos. En 7 casos el tratamiento inicial se modificó con los datos del antibiograma. Se sustituyó por carbapenemas en 3 casos, por amoxicilina-clavulánico en 2, cotrimoxazol en uno y gentamicina en el que había iniciado cefixima. Al alta el tratamiento se realizó con cotrimoxazol en 5 casos, con amoxicilina-clavulánico en 3, erróneamente con cefixima en 2 y con fosfomicina en uno (que se podría considerar subóptimo). Los aislados BLEE+ eran sensibles a estos tratamientos orales, salvo en los casos tratados cefixima, aunque todos evolucionaron favorablemente. Es llamativo un artículo en el que, aunque solo 4 de 28 pacientes con ITU febril por aislados BLEE+ recibieron tratamiento empírico apropiado, el 95% tuvieron una evolución clínica y microbiológica favorable21. Atribuyen este hecho a que, aunque el tratamiento fuera inapropiado, con la administración intravenosa se conseguían objetivos farmacocinéticos y farmacodinámicos favorables en las vías urinarias como una concentración altísima del antibiótico7,21.
Nuestro estudio, aunque recoge datos de 9años, tiene el inconveniente del pequeño número de casos, dada la rareza de estos aislados, que probablemente condicionó que algunas de las diferencias observadas, sobre todo en la frecuencia de reflujo de cualquier grado y quizá de alto grado, no alcanzaran significación estadística. Otro inconveniente es que el estudio está limitado a niños menores de 2años para los que el diagnóstico de ITU febril o pielonefritis ha sido durante muchos años indicación de ingreso en nuestro hospital. El estudio es retrospectivo y algunas variables de interés no quedaron recogidas en las historias clínicas y no pudieron ser analizadas, como el antecedente de consumo reciente de antimicrobianos.
De la revisión de la literatura y de los datos de nuestro estudio se podría deducir que en el tratamiento de los episodios de ITU/PNA hospitalizados que hayan recibido antibióticos o hayan sido ingresados en los 1-3meses previos, presenten enfermedades de base o alteraciones anatómicas o funcionales de las vías urinarias, tengan mayor frecuencia de recidivas o hayan recibido quimioprofilaxis, debería considerarse la opción de cubrir microorganismos BLEE+ para prevenir un tratamiento subóptimo y la posibilidad de daño renal. A pesar de las limitaciones del estudio, los datos en la literatura en niños son escasos y la prevalencia de estos aislados es cada vez mayor, razón por la que consideramos que la información aportada por este estudio puede tener interés. Sería deseable el diseño de un estudio prospectivo a gran escala para definir mejor en niños la frecuencia y las características clinicoevolutivas de estas infecciones en nuestro entorno y superar los inconvenientes de los estudios retrospectivos con limitaciones en la recogida de datos y en el número de aislados BLEE+9.
FinanciaciónEste estudio no ha recibido financiación.
Conflicto de interesesLos autores de este estudio no presentan conflictos de intereses.