Dado el creciente uso de las terapias biológicas en distintas enfermedades reumatológicas, y la importancia de la gestión de riesgo de las mismas, desde la Sociedad Española de Reumatología (SER) se ha impulsado el desarrollo de recomendaciones basadas en la mejor evidencia posible. Estas deben de servir de referencia para reumatólogos e implicados en el tratamiento de pacientes en tratamiento o en los que se quiere indicar la terapia biológica independientemente de su enfermedad de base.
MétodosLas recomendaciones se emitieron siguiendo la metodología de grupos nominales. El nivel de evidencia y el grado de recomendación se clasificaron según el modelo del Center for Evidence Based Medicine de Oxford y el grado de acuerdo se extrajo por técnica Delphi. Se utilizó toda la información de consensos y guías de práctica clínica previas.
ResultadosSe realizan recomendaciones sobre la gestión del riesgo del uso de las terapias biológicas en pacientes con enfermedades reumática. Incluyen la gestión del riesgo de la indicación, gestión del riesgo antes de iniciar el tratamiento, gestión del riesgo durante el seguimiento, actitud ante acontecimientos adversos, y actitud en situaciones especiales.
ConclusionesSe presentan las recomendaciones SER sobre la gestión del riesgo del tratamiento con terapias biológicas.
Due to the increasing use of biologic therapy in rheumatic diseases and the importance of its risk management, the Spanish Society of Rheumatology (SER) has promoted the development of recommendations based on the best evidence available. These recommendations should be a reference to rheumatologists and those involved in the treatment of patients who are using, or about to use biologic therapy irrespectively of the rheumatic disease.
MethodsRecommendations were developed following a nominal group methodology and based on systematic reviews. The level of evidence and degree of recommendation were classified according to the model proposed by the Center for Evidence Based Medicine at Oxford. The level of agreement was established through a Delphi technique. Evidence from previous consensus and clinical guidelines was used.
ResultsWe have produced recommendations on risk management of biologic therapy in rheumatic patients. These recommendations include indication risk management, risk management before the use of biologic therapy, risk management during follow-up, attitude to adverse events, and attitude to special situations.
ConclusionsWe present the SER recommendations related to biologic therapy risk management.
El objetivo del presente documento es el de elaborar recomendaciones sobre la gestión del riesgo de las terapias biológicas en pacientes con enfermedades reumáticas, independientemente de su enfermedad de base.
Las terapias biológicas son, según la Agencia Europea del Medicamento, aquellos productos utilizados en el tratamiento de enfermedades que se elaboran por biotecnología, a partir de células cultivadas de bancos celulares, con la excepción de metabolitos microbianos, como por ejemplo, los antibióticos, aminoácidos, hidratos de carbono, y otras sustancias de bajo peso molecular. Estas terapias han sido diseñadas de forma que actúan, de manera específica sobre una diana terapéutica considerada importante en el proceso patogénico de la enfermedad.
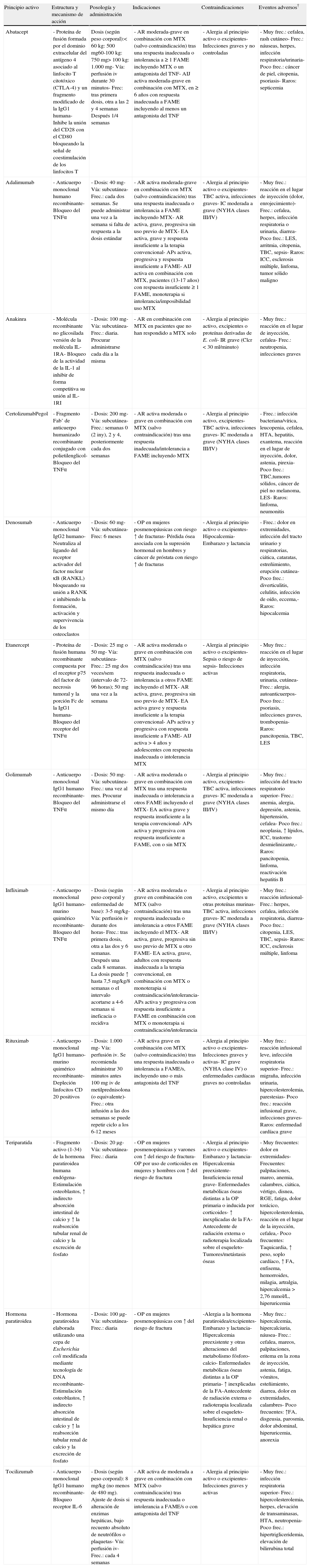
Actualmente disponemos de varias terapias biológicas autorizadas en nuestro país (tabla 1) con indicaciones para la artritis reumatoide (AR), espondilitis anquilosante (EA), artritis psoriásica (APs), artritis idiopática juvenil y osteoporosis (OP). Incluyen infliximab (IFX), etanercept (ETN), adalimumab (ADA), anakinra, abatacept (ABT), rituximab (RTX), tocilizumab (TCZ), certolizumab (CZP), golimumab, denosumab, teriparatida y rh-PTH 1-84.
Terapias biológicas aprobadas en España y sus características (según ficha técnica)*
| Principio activo | Estructura y mecanismo de acción | Posología y administración | Indicaciones | Contraindicaciones | Eventos adversos† |
| Abatacept | - Proteína de fusión formada por el dominio extracelular del antígeno 4 asociado al linfocito T citotóxico (CTLA-4) y un fragmento modificado de la IgG1 humana- Inhibe la unión del CD28 con el CD80 bloqueando la señal de coestimulación de los linfocitos T | Dosis (según peso corporal):< 60 kg: 500 mg60-100 kg: 750 mg> 100 kg: 1.000 mg- Vía: perfusión iv durante 30 minutos- Frec: tras primera dosis, otra a las 2 y 4 semanas Después 1/4 semanas | - AR moderada-grave en combinación con MTX (salvo contraindicación) tras una respuesta inadecuada o intolerancia a ≥ 1 FAME incluyendo MTX o un antagonista del TNF- AIJ activa moderada-grave en combinación con MTX, en ≥ 6 años con respuesta inadecuada a FAME incluyendo al menos un antagonista del TNF | - Alergia al principio activo o excipientes- Infecciones graves y no controladas | - Muy frec.: cefalea, rash cutáneo- Frec.: náuseas, herpes, infección respiratoria/urinaria- Poco frec.: cáncer de piel, citopenia, psoriasis- Raros: septicemia |
| Adalimumab | - Anticuerpo monoclonal humano recombinante- Bloqueo del TNFα | - Dosis: 40 mg- Vía: subcutánea- Frec.: cada dos semanas. Se puede administrar una vez a la semana si falta de respuesta a la dosis estándar | - AR activa moderada-grave en combinación con MTX (salvo contraindicación) tras una respuesta inadecuada o intolerancia a FAME incluyendo MTX- AR activa, grave, progresiva sin uso previo de MTX- EA activa, grave y respuesta insuficiente a la terapia convencional- APs activa, progresiva y respuesta insuficiente a FAME- AIJ activa en combinación con MTX, pacientes (13-17 años) con respuesta insuficiente ≥ 1 FAME, monoterapia si intolerancia/imposibilidad uso MTX | - Alergia al principio activo o excipientes- TBC activa, infecciones graves- IC moderada a grave (NYHA clases III/IV) | - Muy frec.: reacción en el lugar de inyección (dolor, enrojecimiento)- Frec.: cefalea, herpes, infección respiratoria o urinaria, diarrea- Poco frec.: LES, arritmia, citopenia, TBC, sepsis- Raros: ICC, esclerosis múltiple, linfoma, tumor sólido maligno |
| Anakinra | - Molécula recombinante no glicosilada versión de la molécula IL-1RA- Bloqueo de la actividad de la IL-1 al inhibir de forma competitiva su unión al IL-1RI | - Dosis: 100 mg- Vía: subcutánea- Frec.: diaria. Procurar administrarse cada día a la misma | - AR en combinación con MTX en pacientes que no han respondido a MTX solo | - Alergia al principio activo, excipientes o proteínas derivadas de E. coli- IR grave (Clcr < 30 ml/minuto) | - Muy frec.: reacción en el lugar de inyección, cefalea- Frec.: neutropenia, infecciones graves |
| CertolizumabPegol | - Fragmento Fab’ de anticuerpo humanizado recombinante conjugado con polietilenglicol- Bloqueo del TNFα | - Dosis: 200 mg- Vía: subcutánea- Frec.: semanas 0 (2 iny), 2 y 4, posteriormente cada dos semanas | - AR activa moderada o grave en combinación con MTX (salvo contraindicación) tras una respuesta inadecuada/intolerancia a FAME incluyendo MTX | - Alergia al principio activo, excipientes- TBC activa, infecciones graves- IC moderada a grave (NYHA clases III/IV) | - Frec.: infección bacteriana/vírica, leucopenia, cefalea, HTA, hepatitis, exantema, reacción en el lugar de inyección, dolor, astenia, pirexia- Poco frec.: TBC,tumores sólidos, cáncer de piel no melanoma, LES- Raros: linfoma, neumonitis |
| Denosumab | - Anticuerpo monoclonal IgG2 humano-Neutraliza al ligando del receptor activador del factor nuclear κB (RANKL) bloqueando su unión a RANK e inhibiendo la formación, activación y supervivencia de los osteoclastos | - Dosis: 60 mg- Vía: subcutánea- Frec: 6 meses | - OP en mujeres posmenopáusicas con riesgo ↑ de fracturas- Pérdida ósea asociada con la supresión hormonal en hombres y cáncer de próstata con riesgo ↑ de fracturas | - Alergia al principio activo o excipientes- Hipocalcemia- Embarazo y lactancia | - Frec.: dolor en extremidades, infección del tracto urinario y respiratorias, ciática, cataratas, estreñimiento, erupción cutánea- Poco frec.: diverticulitis, celulitis, infección de oído, eccema,- Raros: hipocalcemia |
| Etanercept | - Proteína de fusión humana recombinante compuesta por el receptor p75 del factor de necrosis tumoral y la porción Fc de la IgG1 humana- Bloqueo del receptor del TNFα | - Dosis: 25mg o 50 mg- Vía: subcutánea- Frec.: 25mg dos veces/sem (intervalo de 72-96 horas); 50mg una vez a la semana | - AR activa moderada o grave en combinación con MTX (salvo contraindicación) tras una respuesta inadecuada o intolerancia a otros FAME incluyendo el MTX- AR activa, grave, progresiva sin uso previo de MTX- EA activa grave y respuesta insuficiente a la terapia convencional- APs activa y progresiva con respuesta insuficiente a FAME- AIJ activa > 4 años y adolescentes con respuesta inadecuada o intolerancia MTX | - Alergia al principio activo o excipientes- Sepsis o riesgo de sepsis- Infecciones activas | - Muy frec.: reacción en el lugar de inyección, infección respiratoria, urinaria, cutánea- Frec.: alergia, autoanticuerpos- Poco frec.: psoriasis, infecciones graves, trombopenia- Raros: pancitopenia, TBC, LES |
| Golimumab | - Anticuerpo monoclonal IgG1 humano recombinante- Bloqueo del TNFα | - Dosis: 50 mg- Vía: subcutánea- Frec.: una vez al mes. Procurar administrarse el mismo día | - AR activa moderada o grave en combinación con MTX tras una respuesta inadecuada o intolerancia a otros FAME incluyendo el MTX- EA activa grave y respuesta insuficiente a la terapia convencional- APs activa y progresiva con respuesta insuficiente a FAME, con o sin MTX | - Alergia al principio activo, excipientes- TBC activa, infecciones graves- IC moderada a grave (NYHA clases III/IV) | - Muy frec.: infección del tracto respiratorio superior- Frec.: anemia, alergia, depresión, astenia, hipertensión, cefalea- Poco frec.: neoplasia, ↑ lípidos, ICC, trastorno desmielinizante,- Raros: pancitopenia, linfoma, reactivación hepatitis B |
| Infliximab | - Anticuerpo monoclonal IgG1 humano-murino quimérico recombinante- Bloqueo del TNFα | - Dosis (según peso corporal y enfermedad de base): 3-5 mg/kg- Vía: perfusión iv durante dos horas- Frec.: tras primera dosis, otra a las dos y 6 semanas. Después una cada 8 semanas. La dosis puede ↑ hasta 7,5 mg/kg/8 semanas o el intervalo acortarse a 4-6 semanas si ineficacia o recidiva | - AR activa moderada o grave en combinación con MTX (salvo contraindicación) tras una respuesta inadecuada o intolerancia a otros FAME incluyendo el MTX- AR activa, grave, progresiva sin uso previo de MTX u otro FAME- EA activa, grave, adultos con respuesta inadecuada a la terapia convencional, en combinación con MTX o monoterapia si contraindicación/intolerancia- APs activa y progresiva con respuesta insuficiente a FAME en combinación con MTX o monoterapia si contraindicación/intolerancia | - Alergia al principio activo, excipientes u otras proteínas murinas- TBC activa, infecciones graves- IC moderada a grave (NYHA clases III/IV) | - Muy frec.: reacción infusional- Frec.: herpes, cefalea, infección respiratoria, diarrea- Poco frec.: citopenia, LES, TBC, sepsis- Raros: ICC, esclerosis múltiple, linfoma |
| Rituximab | - Anticuerpo monoclonal IgG1 humano-murino quimérico recombinante- Depleción linfocitos CD 20 positivos | - Dosis: 1.000 mg- Vía: perfusión iv. Se recomienda administrar 30 minutos antes 100mg iv de metilprednisolona (o equivalente)- Frec.: otra infusión a las dos semanas se puede repetir ciclo a los 6-12 meses | - AR activa grave en combinación con MTX (salvo contraindicación) tras una respuesta inadecuada o intolerancia a FAME/s, incluyendo uno o más antagonista del TNF | - Alergia al principio activo o excipientes- Infecciones graves y activas- IC grave (NYHA clase IV) o enfermedades cardíacas graves no controladas | - Muy frec.: reacción infusional leve, infección respiratoria superior- Frec.: migraña, infección urinaria, hipercolesterolemia, parestesias- Poco frec.: reacción infusional grave, infecciones graves- Raros: enfermedad cardíaca grave |
| Teriparatida | - Fragmento activo (1-34) de la hormona paratiroidea humana endógena- Estimulación osteoblastos, ↑ indirecto absorción intestinal de calcio y ↑ la reabsorción tubular renal de calcio y la excreción de fosfato | - Dosis: 20 μg- Vía: subcutánea- Frec.: diaria | - OP en mujeres posmenopáusicas y varones con ↑ del riesgo de fractura- OP por uso de corticoides en mujeres y hombres con ↑ del riesgo de fractura | - Alergia al principio activo o excipientes- Embarazo y lactancia- Hipercalcemia preexistente- Insuficiencia renal grave- Enfermedades metabólicas óseas distintas a la OP primaria o inducida por corticoides- ↑ inexplicadas de la FA- Antecedente de radiación externa o radioterapia localizada sobre el esqueleto- Tumores/metástasis óseas | - Muy frecuentes: dolor en extremidades- Frecuentes: palpitaciones, mareo, anemia, calambres, ciática, vértigo, disnea, RGE, fatiga, dolor torácico, hipercolesterolemia, reacción en el lugar de la inyección, cefalea,- Poco frecuentes: Taquicardia, ↑ peso, soplo cardíaco, ↑ FA, enfisema, hemorroides, milagia, artralgia, hipercalcemia > 2,76 mmol/L, hiperuricemia |
| Hormona paratiroidea | - Hormona paratiroidea elaborada utilizando una cepa de Escherichia coli modificada mediante tecnología de DNA recombinante- Estimulación osteoblastos, ↑ indirecto absorción intestinal de calcio y ↑ la reabsorción tubular renal de calcio y la excreción de fosfato | - Dosis: 100 μg- Vía: subcutánea- Frec.: diaria | - OP en mujeres posmenopáusicas con ↑ del riesgo de fractura | -Alergia a la hormona paratiroidea/excipientes- Embarazo y lactancia- Hipercalcemia preexistente y otras alteraciones del metabolismo fósforo-calcio- Enfermedades metabólicas óseas distintas a la OP primaria- ↑ inexplicadas de la FA-Antecedente de radiación externa o radioterapia localizada sobre el esqueleto-Insuficiencia renal o hepática grave | - Muy frec.: hipercalcemia, hipercalciuria, náusea- Frec.: cefalea, mareos, palpitaciones, eritema en la zona de inyección, astenia, fatiga, vómitos, esteñimiento, diarrea, dolor en extremidades, calambres- Poco frecuentes: ↑FA, disgeusia, parosmia, dolor abdominal, hiperuricemia, anorexia |
| Tocilizumab | - Anticuerpo monoclonal IgG1 humano recombinante- Bloqueo receptor IL-6 | - Dosis (según peso corporal): 8 mg/kg (no menos de 480 mg). Ajuste de dosis si alteración de enzimas hepáticas, bajo recuento absoluto de neutrófilos o plaquetas- Vía: perfusión iv- Frec.: cada 4 semanas | - AR activa de moderada a grave en combinación con MTX (salvo contraindicación) tras respuesta inadecuada o intolerancia a FAME/s o con antagonista del TNF | - Alergia al principio activo o excipientes- Infecciones graves y activas | - Muy frec.: infección respiratoria superior- Frec.: hipercolesterolemia, herpes, elevación de transaminasas, HTA, neutropenia- Poco frec.: hipertrigliceridemia, elevación de bilirrubina total |
*Los datos de la presente tabla han sido obtenidos de la ficha técnica de la Agencia Española del Medicamento.
†Eventos adversos: Muy frecuentes (al menos 1 de cada 10 pacientes); frecuentes (al menos 1 de cada 100 pacientes); poco frecuentes (al menos 1 de cada 1.000 y menos de 1 de cada 100); raros (al menos 1 de cada 10.000 y menos de 1 de cada 1.000 pacientes).
Abreviaturas: AR: artritis reumatoide; AIJ: artritis idiopática juvenil; APs: artritis psoriásica; EA: espondilitis anquilosante; FA: fosfatasa alkalina; FAME: fármaco modificador de la enfermedad; HTA: hipertensión arterial; IC: insuficiencia cardíaca; ICC: insuficiencia cardíaca congestiva; IR: insuficiencia renal; iv: intravenoso; kg: kilogramo; LES: lupus eritematoso sistémico; mg: miligramo; MTX: metotrexato; NYHA: New York Heart Association; OP: osteoporosis; TBC: tuberculosis; TNF: factor de necrosis tumoral.
Dado que denosumab, reriparatida y rh-PTH 1-84 tienen un mecanismo de acción y perfil de seguridad muy diferentes al resto de terapias biológicas expuestas, y teniendo en cuenta que se tratan con detalle en el documento SER de consenso 2011 sobre osteoporosis, en este consenso solo se van a aportar datos de sus fichas técnicas. Para más información remitimos al lector al consenso SER 2011 sobre osteoporosis.
Finalmente señalar, que este documento se ha consensuado con la intención de servir de guía para todos aquellos profesionales que utilizan en algún momento las terapias biológicas para tratar a pacientes con enfermedades reumáticas.
MétodosEste consenso se ha elaborado a partir de otros documentos de consenso de la SER relacionados como los de manejo de las terapias biológicas en AR1, EspA, APs, así como de las guías de práctica clínica GUIPCAR2 y ESPOGUIA3, y otras publicaciones de interés científico4–6. Se ha considerado que la gestión del riesgo de pacientes en tratamiento con terapias biológicas es un apartado que se repite en los distintos documentos publicados, y que además está sujeto a la variabilidad del panel de expertos que lo elabora. Dicha variabilidad puede inducir a actitudes contradictorias, de modo que se ha estimado oportuno elaborar un único documento de consenso que refleje cómo se deben manejar los riegos del uso de la terapia biológica.
Bajo esta premisa se creó un panel de expertos con los reumatólogos que participaron en la edición de las guías y/o consensos previamente mencionados. A continuación, se recogieron todas las recomendaciones de los distintos documentos y se modificaron o actualizaron (si así se consideró oportuno). Posteriormente, mediante una votación secreta se obtuvo el grado de acuerdo (GA) para cada una de las recomendaciones. Los resultados agregados de esta votación se mostraron a todos los panelistas (Delphi modificado). Las recomendaciones con grado de acuerdo inferior al 70% fueron re-editadas y votadas en una segunda ronda.
El nivel de evidencia (NE) y el grado de recomendación (GR) de cada recomendación se estableció de acuerdo con el modelo del Center for Evidence Based Medicine de Oxford7 por miembros de la unidad de investigación de la SER.
Consideraciones previasFarmacovigilancia y gestión del riesgoLa gestión del riesgo en el uso de medicamentos es una parte muy importante de la farmacovigilancia. Ésta la podemos definir a su vez como la actividad de salud pública que tiene por objetivos la identificación, la cuantificación, la evaluación y la prevención de los riesgos de los medicamentos una vez comercializados, tal y como recoge el real decreto (RD) 1344/2007.
Más concretamente, la gestión del riesgo representa el conjunto de actividades e intervenciones de farmacovigilancia diseñadas para identificar, caracterizar y prevenir o minimizar los riesgos de los medicamentos y evaluar la efectividad de dichas intervenciones. Y es responsabilidad de todos, agencias reguladoras/autoridades sanitarias, compañías farmacéuticas, investigadores, profesionales sanitarios, etc. trabajar en todas ellas.
En los últimos años, con el uso de las terapias biológicas hemos podido identificar una serie de riesgos más o menos asociados a los mismos. Algunos son riesgos identificados como importantes, es decir, aquellos en los que existe una evidencia adecuada de la asociación con el medicamento y son muy relevantes. Otros son riesgos potenciales importantes, sobre los que existe base para la sospecha, pero no hay confirmación. Por otro lado, también conviene indicar que actualmente no disponemos de información relevante suficiente en algunos casos concretos, como por ejemplo, en las denominadas situaciones especiales (embarazo, lactancia, etc.).
En base a todo lo anteriormente expuesto, la gestión del riesgo en relación al uso de la terapia biológica está presente en los siguientes momentos/circunstancias (que se describirán a lo largo del documento): la indicación, el inicio del tratamiento, el seguimiento y en la valoración de acontecimientos adversos que surgen durante el tratamiento. En la mayoría de estos momentos/circunstancias existe evidencia de la mejor actitud a seguir.
Marco normativo en el uso de medicamentos en EspañaFinalmente se debe recordar el marco legal en el que nos encontramos. El RD 1345/2007 regula el uso autorizado de un medicamento, y el RD 1015/2009 el uso de medicamentos en situaciones especiales. Toda esta documentación está accesible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)8.
Medicamentos autorizadosLos medicamentos se pueden utilizar para una condición en la que se ha autorizado una indicación (uso normal, indicación en ficha técnica).
Medicamentos en situaciones especialesUso de medicamentos en investigaciónLa AEMPS puede autorizar el uso de medicamentos en investigación antes de su comercialización en España, para pacientes concretos sin una alternativa terapéutica disponible satisfactoria, que no forman parte de un ensayo clínico y que están en una situación clínica que no permite esperar a que finalice la investigación y los nuevos tratamientos se autoricen. Así el acceso a estos medicamentos podrá hacerse de forma individualizada para un paciente, como hasta ahora (uso compasivo), o acogiéndose a una autorización temporal de uso por la AEMPS para un grupo de pacientes.
Uso de medicamentos en condiciones diferentes de las autorizadasSe trata del uso de medicamentos autorizados, pero para una indicación no autorizada (uso off-label o fuera de las condiciones de uso autorizadas). Este uso queda bajo la responsabilidad del médico prescriptor para el uso individual, pero la AEMPS, si lo estimase oportuno, podría entrar a regular un uso colectivo para esa indicación no autorizada. En ese caso, las recomendaciones de uso –o no uso– que resultasen serían de obligado cumplimiento.
Medicamentos extranjerosLa AEMPS puede autorizar el uso individual de medicamentos que no están autorizados en España, que estén comercializados en otros países y cuya utilización sea imprescindible.
Gestión del riesgo de la indicación de la terapia biológicaLa estimación beneficio/riesgo ante un paciente concreto debe apoyarse en todo el conocimiento disponible desde el momento mismo de la indicación. Por ello:
El panel considera que el tratamiento con terapias biológicas debe ser realizado por médicos que tengan experiencia con el uso de los mismos y habituados al manejo de las enfermedades para las que están indicados (NE 5; GR D; GA 100%).
Se debe consultar la ficha técnica oficial de todos los agentes biológicos y ajustarse a sus recomendaciones, antes de proceder a su utilización en la práctica clínica (NE 5; GR D; GA 91%).
Existe evidencia de que los usos fuera de indicación autorizada pueden tener más acontecimientos adversos que cuando se pauta un fármaco para su indicación autorizada, siendo una garantía que el paciente al que se le prescriben se acerque lo más posible al perfil de la indicación9.
Se debe recordar, que la indicación de la terapia biológica para pacientes con historia de uveítis no está actualmente autorizada, por lo tanto, sería una indicación no autorizada. En este contexto se deben valorar los riesgos relativos derivados de los distintos fármacos y consultar con un oftalmólogo antes de decidir si comenzar el tratamiento con terapias biológicas y en su caso cual utilizar10,11.
Se expone un resumen de las fichas técnicas de las terapias biológicas en la tabla 1.
Gestión del riesgo antes de iniciar el tratamientoTodo paciente que vaya a iniciar tratamiento con terapia biológica debe ser sometido a una evaluación previa para estimar y prevenir los posibles riesgos, y debe ser monitorizado de forma regular durante la terapia (NE 5; GR D; GA 100%).
Antes de iniciar la primera dosis, se debe haber recopilado suficiente información sobre los riesgos potenciales del paciente concreto al que se ha prescrito el medicamento. Para ello, se aconsejan una serie de medidas de cribado o despistaje de comorbilidad, pero además se sugieren medidas proactivas para minimizar en lo posible las reacciones adversas, como son una buena información al paciente y al personal que vaya a manejar la terapia y profilaxis.
La monitorización del paciente debe ser regular y adaptarse a las características propias del paciente y de la organización del servicio, siendo recomendable al menos una evaluación al mes y posteriormente cada 1-4 meses, independientemente de quién y cómo la realice.
Siempre que se indique un tratamiento con terapia biológica se debe instruir al paciente sobre los síntomas de alarma que debe vigilar como posible indicio de algún riesgo (NE 5; GR D; GA 91%).
Cuando se prescriba una terapia biológica, independientemente de la enfermedad, se debe instruir al paciente sobre los síntomas/signos que debe observar y cómo actuar en caso de que se presenten. El paciente debe conocer y reconocer estos riesgos, al menos los más frecuentes. De la misma manera, se puede informar de medidas higiénico-dietéticas que ayuden a disminuir algunos riesgos. Toda esta información está disponible en muchas unidades de reumatología o en la web de la SER12.
La gestión de riesgos del tratamiento con terapias biológicas debe ser dirigida por el médico que la haya indicado o por el que este haya designado; no obstante, esta debería implicar a todo el personal sanitario, incluyendo enfermería, médico de familia y farmacia hospitalaria, y al propio paciente (NE 5; GR D; GA 100%).
La información del médico prescriptor, del que haga la vigilancia si es otro, y de la enfermera, debe ser consistente, para lo cual es fundamental el apoyo en documentación escrita, procesos y procedimientos definidos, claros y precisos, folletos, manual de instrucciones, etc.
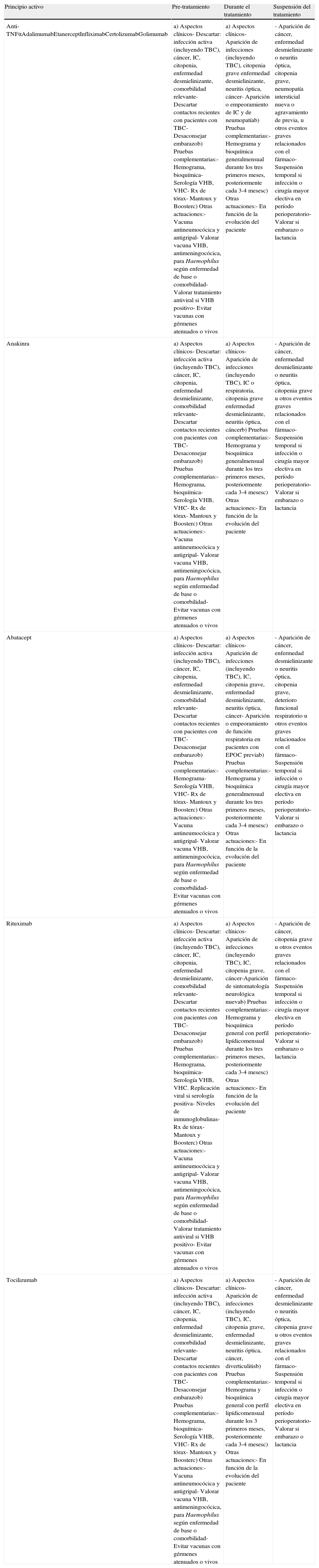
En la tabla 2 se exponen las actuaciones de evaluación previa que se recomiendan realizar al principio del tratamiento. Aunque el perfil de seguridad no es exactamente igual en las diferentes opciones de la terapia biológica, con la información disponible actualmente, y a excepción de denosumab, teriparatida y rh-PTH 1-84, el panel considera que las recomendaciones que se exponen a continuación son aplicables a todos los pacientes que vayan a comenzar una terapia biológica.
Actuaciones previas y monitorización de las terapias biológicas
| Principio activo | Pre-tratamiento | Durante el tratamiento | Suspensión del tratamiento |
| Anti-TNFαAdalimumabEtanerceptInfliximabCertolizumabGolimumab | a) Aspectos clínicos- Descartar: infección activa (incluyendo TBC), cáncer, IC, citopenia, enfermedad desmielinizante, comorbilidad relevante- Descartar contactos recientes con pacientes con TBC- Desaconsejar embarazob) Pruebas complementarias:- Hemograma, bioquímica- Serología VHB, VHC- Rx de tórax- Mantoux y Boosterc) Otras actuaciones:- Vacuna antineumocócica y antigripal- Valorar vacuna VHB, antimeningocócica, para Haemophilus según enfermedad de base o comorbilidad- Valorar tratamiento antiviral si VHB positivo- Evitar vacunas con gérmenes atenuados o vivos | a) Aspectos clínicos- Aparición de infecciones (incluyendo TBC), citopenia grave enfermedad desmielinizante, neuritis óptica, cáncer- Aparición o empeoramiento de IC y de neumopatíab) Pruebas complementarias:- Hemograma y bioquímica generalmensual durante los tres primeros meses, posteriormente cada 3-4 mesesc) Otras actuaciones:- En función de la evolución del paciente | - Aparición de cáncer, enfermedad desmielinizante o neuritis óptica, citopenia grave, neumopatía intersticial nueva o agravamiento de previa, u otros eventos graves relacionados con el fármaco- Suspensión temporal si infección o cirugía mayor electiva en período perioperatorio- Valorar si embarazo o lactancia |
| Anakinra | a) Aspectos clínicos- Descartar: infección activa (incluyendo TBC), cáncer, IC, citopenia, enfermedad desmielinizante, comorbilidad relevante- Descartar contactos recientes con pacientes con TBC- Desaconsejar embarazob) Pruebas complementarias:- Hemograma, bioquímica- Serología VHB, VHC- Rx de tórax- Mantoux y Boosterc) Otras actuaciones:- Vacuna antineumocócica y antigripal- Valorar vacuna VHB, antimeningocócica, para Haemophilus según enfermedad de base o comorbilidad- Evitar vacunas con gérmenes atenuados o vivos | a) Aspectos clínicos- Aparición de infecciones (incluyendo TBC), IC o respiratoria, citopenia grave enfermedad desmielinizante, neuritis óptica, cáncerb) Pruebas complementarias:- Hemograma y bioquímica generalmensual durante los tres primeros meses, posteriormente cada 3-4 mesesc) Otras actuaciones:- En función de la evolución del paciente | - Aparición de cáncer, enfermedad desmielinizante o neuritis óptica, citopenia grave u otros eventos graves relacionados con el fármaco- Suspensión temporal si infección o cirugía mayor electiva en período perioperatorio- Valorar si embarazo o lactancia |
| Abatacept | a) Aspectos clínicos- Descartar: infección activa (incluyendo TBC), cáncer, IC, citopenia, enfermedad desmielinizante, comorbilidad relevante- Descartar contactos recientes con pacientes con TBC- Desaconsejar embarazob) Pruebas complementarias:- Hemograma- Serología VHB, VHC- Rx de tórax- Mantoux y Boosterc) Otras actuaciones:- Vacuna antineumocócica y antigripal- Valorar vacuna VHB, antimeningocócica, para Haemophilus según enfermedad de base o comorbilidad- Evitar vacunas con gérmenes atenuados o vivos | a) Aspectos clínicos- Aparición de infecciones (incluyendo TBC), IC, citopenia grave, enfermedad desmielinizante, neuritis óptica, cáncer- Aparición o empeoramiento de función respiratoria en pacientes con EPOC previab) Pruebas complementarias:- Hemograma y bioquímica generalmensual durante los tres primeros meses, posteriormente cada 3-4 mesesc) Otras actuaciones:- En función de la evolución del paciente | - Aparición de cáncer, enfermedad desmielinizante o neuritis óptica, citopenia grave, deterioro funcional respiratorio u otros eventos graves relacionados con el fármaco- Suspensión temporal si infección o cirugía mayor electiva en período perioperatorio- Valorar si embarazo o lactancia |
| Rituximab | a) Aspectos clínicos- Descartar: infección activa (incluyendo TBC), cáncer, IC, citopenia, enfermedad desmielinizante, comorbilidad relevante- Descartar contactos recientes con pacientes con TBC- Desaconsejar embarazob) Pruebas complementarias:- Hemograma, bioquímica- Serología VHB, VHC. Replicación viral si serología positiva- Niveles de inmunoglobulinas- Rx de tórax- Mantoux y Boosterc) Otras actuaciones:- Vacuna antineumocócica y antigripal- Valorar vacuna VHB, antimeningocócica, para Haemophilus según enfermedad de base o comorbilidad-Valorar tratamiento antiviral si VHB positivo- Evitar vacunas con gérmenes atenuados o vivos | a) Aspectos clínicos- Aparición de infecciones (incluyendo TBC), IC, citopenia grave, cáncer-Aparición de sintomatología neurológica nuevab) Pruebas complementarias:- Hemograma y bioquímica general con perfil lipídicomensual durante los tres primeros meses, posteriormente cada 3-4 mesesc) Otras actuaciones:- En función de la evolución del paciente | - Aparición de cáncer, citopenia grave u otros eventos graves relacionados con el fármaco- Suspensión temporal si infección o cirugía mayor electiva en período perioperatorio- Valorar si embarazo o lactancia |
| Tocilizumab | a) Aspectos clínicos- Descartar: infección activa (incluyendo TBC), cáncer, IC, citopenia, enfermedad desmielinizante, comorbilidad relevante- Descartar contactos recientes con pacientes con TBC- Desaconsejar embarazob) Pruebas complementarias:- Hemograma, bioquímica- Serología VHB, VHC- Rx de tórax- Mantoux y Boosterc) Otras actuaciones:- Vacuna antineumocócica y antigripal- Valorar vacuna VHB, antimeningocócica, para Haemophilus según enfermedad de base o comorbilidad- Evitar vacunas con gérmenes atenuados o vivos | a) Aspectos clínicos- Aparición de infecciones (incluyendo TBC), IC, citopenia grave, enfermedad desmielinizante, neuritis óptica, cáncer, diverticulitisb) Pruebas complementarias:- Hemograma y bioquímica general con perfil lipídicomensual durante los 3 primeros meses, posteriormente cada 3-4 mesesc) Otras actuaciones:- En función de la evolución del paciente | - Aparición de cáncer, enfermedad desmielinizante o neuritis óptica, citopenia grave u otros eventos graves relacionados con el fármaco- Suspensión temporal si infección o cirugía mayor electiva en período perioperatorio- Valorar si embarazo o lactancia |
EPOC: enfermedad pulmonar obstructiva crónica; IC: insuficiencia cardíaca; RX: radiografía simple; TBC: tuberculosis; VHB: virus hepatitis B; VHC: virus de hepatitis C.
Ante un paciente que vaya a empezar un tratamiento biológico, se debe evaluar la posible existencia de una infección activa; la presencia de la misma constituye una contraindicación de la terapia biológica (NE 2b; GR B; GA 96%).
En el registro español de reacciones adversas a las terapias biológicas (BIOBADASER) y en otros registros y/o estudios, se ha encontrado una mayor incidencia de infecciones en los pacientes con estas terapias, independientemente de la enfermedad de base13–28.
El uso de las terapias biológicas, en pacientes con antecedentes de infecciones de repetición, sepsis o con alto riesgo de desarrollar una infección, es poco recomendable o requiere un balance riesgo-beneficio apropiado y de una máxima vigilancia. Tampoco se debe comenzar un tratamiento con estos fármacos si existe una infección activa, sistémica o localizada. En este sentido, el antecedente de una prótesis articular infectada obliga a realizar antes del inicio de una terapia biológica, el adecuado abordaje terapéutico (cirugía con eliminación radical de la infección y, si está indicado, el reemplazamiento protésico).
Ante el aumento de la población inmigrante, y en función de su procedencia geográfica, se recomienda valorar la posible reactivación de infecciones poco habituales en nuestro entorno.
Una vez resuelta la infección, se puede iniciar la terapia biológica.
El panel considera obligado excluir en todo paciente que vaya a iniciar la terapia biológica, la existencia de TBC activa o contacto reciente con enfermos con TBC, así como investigar la posibilidad de infección tuberculosa latente. Para ello propone que se recojan en la historia clínica los antecedentes de TBC y contactos recientes con pacientes con TBC y se realice una radiografía de tórax para descartar TBC activa o signos radiográficos concordantes con una antigua infección tuberculosa, así como una prueba cutánea de la tuberculosis (PPD), que debe ser repetida (re-test) a las 1-2 semanas si es < 5mm (NE 2b; GR B; GA 100%).
Se ha detectado una mayor incidencia de tuberculosis (TBC) en pacientes que recibían fármacos antagonistas de TNF, especialmente con los anticuerpos monoclonales5,23,24,29–31. Por otro lado, el despistaje se ha asociado a reducción del riesgo de reactivación de la TBC latente5,32. Se considera un PPD o re-test positivo en un paciente sometido a inmunosupresión con una induración mayor o igual de 5mm a las 72h. El resultado se debe considerar independientemente de la vacunación previa tuberculosa. También es importante instruir a los pacientes sobre el riesgo que conlleva su exposición a pacientes con TBC activa.
Se debe instaurar tratamiento para infección tuberculosa latente antes del inicio de la terapia biológica en las siguientes circunstancias: a) contacto reciente con paciente con TBC documentada; b) antecedentes de TBC parcialmente tratada; c) test de PPD o re-test positivo; o d) lesiones residuales en la radiografía de tórax. La pauta de elección para el tratamiento de la infección tuberculosa latente es con isoniazida (5mg/kg/día hasta un máximo de 300mg diarios) con suplementos de vitamina B6, durante 9 meses (NE 2b; GR B; GA 96%).
En caso de intolerancia a la isoniazida, se recomienda rifampicina en dosis de 10mg/kg/día (máximo, 600mg diarios) durante 4 meses. La efectividad de estas normas para prevenir la reactivación de la TBC latente está demostrada32. Están apareciendo estudios con pautas cortas33 y varias drogas, si bien estamos a la espera de la confirmación de su eficacia en población inmunodeprimida.
Si el paciente ha recibido un tratamiento adecuado de infección TBC latente o activa, no es necesario hacer profilaxis ni Mantoux (NE 5; GR D; GA 96%). Sin embargo, se recomienda un seguimiento en este tipo de pacientes.
Antes de empezar un tratamiento biológico se debe tener en cuenta la historia de tumores malignos. Cuando existe un antecedente de cáncer sólido se debe valorar la biología y comportamiento del mismo, discutiendo con el oncólogo y con el paciente el riesgo de recidiva. No se recomienda el uso de terapia biológica en pacientes con antecedentes de enfermedad linfoproliferativa (NE 4; GR C; GA 91%).
No hay evidencia actual de riesgo incrementado de tumores sólidos en pacientes con terapia biológica18,34,35, aunque parece existir un riesgo aumentado en relación a tumores cutáneos no melanocíticos (basocelular) al menos en pacientes con AR36. Por ello, en pacientes con antecedente de tumor sólido la indicación de la terapia biológica se valorará en función de los riesgos y beneficios.
Por otro lado, existen datos discordantes en lo referente al riesgo de desarrollar enfermedades linfoproliferativas con el uso de antagonistas de TNF (ver fichas técnicas) en la AR37–41, y no parece existir asociación en las EspA42. Mientras no se aclare definitivamente esta cuestión, se desaconseja el uso de antagonistas de TNF si existen antecedentes de enfermedad linfoproliferativa.
Antes de empezar un tratamiento biológico se debe evaluar la existencia de insuficiencia cardíaca (NE 4; GR C; GA 91%).
Aunque los datos disponibles (en relación a los antagonistas de TNF y RTX) no son del todo consistentes43–45, en pacientes con insuficiencia cardíaca leve, se debe vigilar al paciente y suspender el tratamiento en caso de que aparezcan datos de empeoramiento del fracaso cardíaco. No se debe iniciar tratamiento en aquellos pacientes con grado funcional III o IV de la NYHA.
En general se debe individualizar la administración de la terapia biológica a pacientes con enfermedad pulmonar intersticial subyacente (NE 4; GR C; GA 96%).
El uso de las terapias biológicas en pacientes con enfermedad pulmonar intersticial puede asociarse a un riesgo (aunque poco estudiado y definido) de empeoramiento y desenlace fatal46,47. Este riesgo podría estar aumentado en pacientes con antecedentes previos de afección pulmonar, y los peores desenlaces se han descrito en pacientes con neumonitis intersticial usual, por lo que se debe prestar especial atención a este antecedente46,47. A la espera de más evidencia al respecto el uso en este tipo de pacientes debe individualizarse.
Antes de empezar un tratamiento biológico se debe evaluar la existencia de citopenias, y si existiera no se comenzará el tratamiento con terapia biológica hasta que se resuelva (NE 2b; GR B; GA 74%).
En caso de citopenia grave no se recomienda iniciar el tratamiento hasta que se haya resuelto. Pero, por otro lado, dado que la citopenia puede ser debida a la actividad de la enfermedad de base se debe estudiar su origen y actuar en consecuencia.
Antes de empezar un tratamiento biológico se debe evaluar la existencia de enfermedad desmielinizante y en general debe evitar su uso en personas con antecedentes claros de tales procesos (NE 2b; GR B; GA 91%).
Se han descrito casos de enfermedad desmielinizante con el uso de antagonistas de TNF48–50 y existe según ficha técnica, un riesgo potencial con TCZ y ABT, aunque no queda claro si el uso de estos medicamentos realmente aumenta el riesgo de aparición de la misma. Este despistaje se puede hacer clínicamente y en caso de duda consultar con un neurólogo o especialista oportuno. En caso de enfermedad desmielinizante previa, la indicación de la terapia biológica se valorará individualmente en función de los riesgos y beneficios, aunque en general se deberá evitar.
Se recomienda realizar serología VHC y marcadores de VHB (NE 4; GR C; GA 100%).
En pacientes con VHB y antagonistas del TNF se han descrito casos de reactivación de la infección e incluso de fracaso hepático fulminante51–53. Con RTX hay datos de reactivación54. En el caso del VHC no está claro que el tratamiento con antagonistas de TNF ni el uso de ABT origine un deterioro de la función hepática o aumento de la carga viral y se ha descrito incluso mejoría en algunas pruebas funcionales55–59. Con RTX tampoco está claro60,61. En relación con el virus de la inmunodeficiencia humana (VIH), existen series de casos en los que los agentes biológicos se han mostrado eficaces, pero en las que también se ha visto un aumento del número de infecciones62. Por ello, consideramos que cada caso debe individualizarse y valorar la relación riesgo/beneficio. Y, especialmente en el caso del VHB recomendamos una valoración previa/conjunta por el hepatólogo/infectólogo para la monitorización del riesgo de reactivación y la decisión de inicio y mantenimiento de los antivirales.
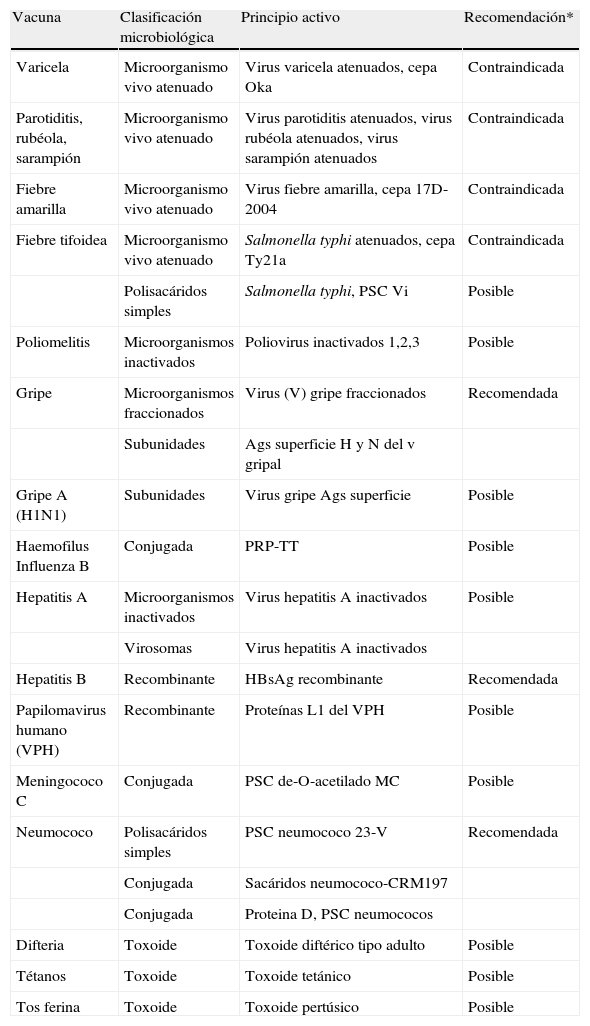
Se recomiendan las siguientes vacunas en pacientes que vayan a ser tratados con terapia biológica: vacuna neumocócica y vacuna gripal (NE 3b; GR C; GA 96%).
Por otro lado se contraindica el uso las vacunas con microorganismos vivos atenuados. Dado el grado de inmunosupresión que induce la terapia biológica, el riesgo potencial de infección con la prescripción puede ser importante, por lo que se desaconseja su uso.
En principio, si no hay otros factores el resto de vacunas se pueden prescribir. Para más información sobre las vacunas se puede consultar la tabla 3.
Principales características de algunas de las vacunas disponibles en España y su recomendación en caso de uso de la terapia biológica
| Vacuna | Clasificación microbiológica | Principio activo | Recomendación* |
| Varicela | Microorganismo vivo atenuado | Virus varicela atenuados, cepa Oka | Contraindicada |
| Parotiditis, rubéola, sarampión | Microorganismo vivo atenuado | Virus parotiditis atenuados, virus rubéola atenuados, virus sarampión atenuados | Contraindicada |
| Fiebre amarilla | Microorganismo vivo atenuado | Virus fiebre amarilla, cepa 17D-2004 | Contraindicada |
| Fiebre tifoidea | Microorganismo vivo atenuado | Salmonella typhi atenuados, cepa Ty21a | Contraindicada |
| Polisacáridos simples | Salmonella typhi, PSC Vi | Posible | |
| Poliomelitis | Microorganismos inactivados | Poliovirus inactivados 1,2,3 | Posible |
| Gripe | Microorganismos fraccionados | Virus (V) gripe fraccionados | Recomendada |
| Subunidades | Ags superficie H y N del v gripal | ||
| Gripe A (H1N1) | Subunidades | Virus gripe Ags superficie | Posible |
| Haemofilus Influenza B | Conjugada | PRP-TT | Posible |
| Hepatitis A | Microorganismos inactivados | Virus hepatitis A inactivados | Posible |
| Virosomas | Virus hepatitis A inactivados | ||
| Hepatitis B | Recombinante | HBsAg recombinante | Recomendada |
| Papilomavirus humano (VPH) | Recombinante | Proteínas L1 del VPH | Posible |
| Meningococo C | Conjugada | PSC de-O-acetilado MC | Posible |
| Neumococo | Polisacáridos simples | PSC neumococo 23-V | Recomendada |
| Conjugada | Sacáridos neumococo-CRM197 | ||
| Conjugada | Proteina D, PSC neumococos | ||
| Difteria | Toxoide | Toxoide diftérico tipo adulto | Posible |
| Tétanos | Toxoide | Toxoide tetánico | Posible |
| Tos ferina | Toxoide | Toxoide pertúsico | Posible |
En pacientes con marcadores negativos de hepatitis B es aconsejable la vacunación previa al inicio del tratamiento con terapia biológica (NE 3b; GR C; GA 78%).
En referencia a las vacunas, distintas publicaciones han puesto de manifiesto una buena respuesta humoral en el caso de los antagonistas de TNF y ABT para microorganismos como el virus de la influenza, neumococo o la toxina del tétanos63–66, siendo hasta la fecha contradictorios en el caso de RTX67,68. No se dispone de suficiente información en relación a otros fármacos.
En cualquier caso, siempre se tendrá en cuenta que estas vacunas pueden ser poco efectivas si el paciente presenta una inmunosupresión intensa. Una vez iniciada la terapia biológica no se deben utilizar vacunas que contengan gérmenes vivos. Para más información consultar la tabla 3.
Se debería desaconsejar el embarazo y la lactancia a las pacientes que vayan a iniciar terapia biológica; el uso de denosumab está contraindicado en el embarazo y la lactancia (NE 3b; GR C; GA 91%).
En general, aunque no se dispone de suficiente evidencia69–71 se debería desaconsejar al paciente que reciba terapia biológica durante el embarazo y la lactancia. Es prioritario que los pacientes y sus médicos discutan la planificación de la gestación en relación con el uso de estos agentes terapéuticos.
Gestión del riesgo durante el seguimientoDurante la exposición al fármaco, se establecerán intervalos regulares de tiempo para realizar una monitorización lo más sistemática posible de acontecimientos concretos (NE 5; GR D; GA 100%).
La gestión del riesgo durante el tratamiento con terapias biológicas incluye una evaluación clínica y examen físico completo, así como pruebas complementarias (laboratorio, de imagen, etc.) en función de cada fármaco y situación clínica (NE 5; GR D; GA 91%).
Se debe realizar un seguimiento del tratamiento, en colaboración y comunicación con el médico de Atención Primaria (NE 5; GR D; GA 96%).
El seguimiento estrecho y sistematizado ha demostrado que minimiza los efectos adversos de cualquier fármaco. De hecho, es norma que en los ensayos clínicos ocurran menos efectos adversos precisamente por una vigilancia estrecha. Cualquier vía que facilite la comunicación entre Atención Primaria y el responsable del tratamiento, incluso del paciente con cualquiera de estos, es esperable que repercuta favorablemente en la seguridad del paciente.
Durante el seguimiento se debe hacer especial hincapié en el despistaje de acontecimientos adversos, en especial infecciones, afectación pulmonar, cardíaca, y en casos específicos de alteraciones analíticas (discrasias, lípidos, función hepática) y preguntar por contactos con pacientes infecciosos (tuberculosis o varicela entre otros) (NE 5; GR D; GA 96%).
Para una consulta más detallada sobre la gestión del riesgo durante el tratamiento con terapias biológicas consultar las tablas 1 y 2.
Es recomendable hacer un seguimiento exhaustivo de los pacientes con infección activa por el VHB, VHC o VIH si inician terapia biológica (NE 5; GR B; GA 100%).
Aunque la evidencia disponible es todavía escasa51,55–58,62, si finalmente se decide iniciar terapia biológica en pacientes con VHB, VHC o VIH, el seguimiento debe incluir al menos: serología, carga viral, recuentos de CD4, y pruebas de función hepática. En el caso del VHB, se debe valorar el uso de terapia antiviral, y en el caso del VIH la terapia biológica siempre debería asociarse a terapia antirretroviral intensa (que debe iniciarse antes del inicio de la terapia biológica). Como hemos comentado anteriormente, recomendamos consultar al especialista en caso de duda.
Actitud ante acontecimientos adversosSe debe prestar una atención muy especial al posible desarrollo de infecciones durante el tratamiento. En esta situación, el diagnóstico y el tratamiento precoces, así como la supresión temporal de la terapia biológica, son fundamentales. Una vez resuelta la infección, se puede reiniciar el tratamiento biológico (NE 2b; GR B; GA 100%).
Las infecciones son los acontecimientos más frecuentes. En ocasiones pueden debutar con cuadros complicados y/o graves, por lo que es fundamental siempre sospecharlas13,20,29,72–76. Se han descrito casos de diverticulitis con perforación intestinal con el uso de TCZ77, por lo que ante todo paciente con cuadro clínico de abdomen agudo/subagudo debe valorarse esta posibilidad.
Durante el seguimiento se recomienda preguntar por la posibilidad de contacto con pacientes con tuberculosis. En caso positivo o dudoso, se debe repetir el test cutáneo de tuberculosis o tratar la exposición con isoniazida (NE 5; GR D; GA 91%).
Aunque previo al tratamiento se haya realizado el screening de tuberculosis o incluso profilaxis farmacológica, la posibilidad de infección tuberculosa sigue existiendo, por lo que es necesario tener en cuenta esta posibilidad durante el seguimiento y actuar en consecuencia.
El quantiFERON es un test inmunológico in vitro basado en la rápida producción de IFN-γ por células mononucleares circulantes en respuesta a antígenos que son más específicos para la detección de infección tuberculosa que el PPD. Su uso en pacientes con enfermedades inflamatorias de origen inmune ha mostrado una fuerte correlación con factores de riesgo para tuberculosis y bajo porcentaje de resultados indeterminados. Sin embargo, se necesitan más estudios para valorar su uso en pacientes en tratamiento con antagonistas del TNF78.
No existe evidencia que respalde un tiempo mínimo necesario de tratamiento de la tuberculosis para poder iniciar la terapia biológica. La experiencia clínica hace aconsejable la mayor duración posible de éste, siempre manteniendo al paciente en una actividad de la enfermedad de base razonable.
Si el paciente desarrolla un cáncer durante el tratamiento con un agente biológico, se debe suspender el tratamiento (NE 2b; GR B; GA 96%).
Se debe prestar especial atención a la detección de las neoplasias malignas36,39,42,79–82. Entre otras situaciones, se establecerá la sospecha clínica cuando se detecte una discordancia entre la sintomatología clínica y los niveles séricos de los reactantes de fase aguda, el recuento de leucocitos o la concentración de hemoglobina83.
También es aconsejable explicar al paciente que se observe y comunique cualquier cambio en la piel.
Se debe tener una especial precaución con los antagonistas del TNF y RTX en pacientes con insuficiencia cardíaca, ya que esta puede agravarse considerablemente, en cuyo caso debe suspenderse el medicamento (NE 4; GR C; GA 91%).
Aunque se precisa de mayor evidencia43,44, en caso de que aparezcan datos clínicos y/o ecográficos de empeoramiento de la insuficiencia cardíaca se debe suspender la medicación.
En pacientes con enfermedad intersticial pulmonar en tratamiento con terapia biológica se debe tener un estricto control clínico y de la función pulmonar, y, en casos de empeoramiento clínico y extensión de las lesiones de la enfermedad pulmonar se debe abandonar la terapia biológica (NE 4; GR C; GA 96%).
Se han descrito casos de empeoramiento de enfermedad pulmonar intersticial con desenlace fatal en pacientes en tratamiento con antagonistas del TNF46,47, aunque recientemente se ha publicado que la mortalidad en pacientes con AR y enfermedad pulmonar intersticial no aumenta con antagonistas de TNF en comparación con FAME tradicionales. La proporción de muertes atribuibles a la enfermedad pulmonar intersticial es mayor en los pacientes tratados con antagonistas de TNF, aunque puede existir un sesgo de información84. Este es un tema poco estudiado actualmente, en el que la relación causa/efecto está mal determinada, por lo que a la espera de más evidencia al respecto, se valorará individualmente el riego/beneficio.
En caso de citopenia grave durante el tratamiento con terapia biológica, se recomienda suspenderlo y buscar otras causas posibles antes de imputarla a la terapia biológica. Una vez resuelta se puede reinstaurar la misma (NE 4; GR C; GA 96%).
Se han descrito casos raros de leucopenia o trombopenia graves y anemia aplásica en pacientes tratados con terapia biológica85, que en el caso de aparición obligarían a suspender la misma si es debido a estos fármacos y valorar su reintroducción una vez resuelta. Por su mecanismo de acción, el RTX puede provocar linfopenia, que no sería (per sé) motivo de suspensión. En el caso de TZC se produce citopenia por efecto farmacodinámico con frecuencia y tiene recomendaciones de manejo (en la literatura y en su ficha técnica). Por otro lado, la anemia, leucopenia, linfopenia o trombopenia pueden ser consecuencia de la actividad de la enfermedad. En todo caso se debería estudiar su origen y decidir en función de un beneficio/riesgo.
En caso de aparición de síndromes lupus-like u otro trastorno autoinmune relevante se recomienda suspender el tratamiento con terapia biológica (NE 2b; GR B; GA 96%).
Aunque es poco frecuente, se debe monitorizar la posible aparición de estos fenómenos86–88. La presencia de anticuerpos típicos de lupus en ausencia de otros signos o síntomas, no es motivo para la suspensión.
Se deben suspender los agentes antagonistas de TNF y TCZ, si aparece un cuadro compatible con proceso desmielinizante o neuritis óptica (NE 2b; GR B; GA 96%).
Se ha relacionado el tratamiento con antagonistas de TNF y TCZ con la aparición de neuritis óptica, esclerosis múltiple y otros trastornos desmielinizantes49,50, por lo que se suspenderán en caso de aparición.
En caso de activación o aparición de hepatitis B o C o VIH se debe asociar tratamiento antiviral a la terapia biológica (NE 4; GR C; GA 87%).
En la serie más larga hasta ahora, 14 pacientes con infección crónica por VHB, 19 pacientes con VHB vacunados y 19 pacientes con infección por VHB resuelta recibieron terapia de combinación con antivirales orales y antagonistas de TNF. Durante el tratamiento, los niveles de anticuerpos de superficie del VHB desaparecieron o fueron controlados. No se encontraron problemas de seguridad89. No obstante, la opción de suspender temporalmente la terapia biológica hasta que la instauración de un tratamiento anti-viral efectivo controle la replicación del virus no puede descartarse.
En el caso de aparición de lesiones psoriásicas en pacientes con terapia biológica, se debe instaurar un tratamiento apropiado para las lesiones y valorar su suspensión en caso de que este fracase o si la afectación cutánea es grave (NE 4; GR C; GA 96%).
Se han comunicado casos de psoriasis cutánea, fundamentalmente palmoplantar, así como la exacerbación o el cambio de morfología de las lesiones psoriásicas preexistentes con el uso de estos fármacos90–93, que hace necesaria la vigilancia ante la posible aparición de las mismas.
Gestión del riesgo en situaciones especialesEn caso de embarazo durante el tratamiento con terapia biológica se suspenderá el tratamiento (NE 4; GR C; GA 78%).
En caso de embarazo, se suspenderá el tratamiento con el agente biológico69,70,94. Para más información consultar la tabla 4. En hombres, en principio, aunque se ha sugerido la posibilidad de asociación con astenoazoospermia y disminución en la movilidad de los espermatozoides95–98, no hay datos concluyentes de que disminuya la fertilidad en hombres que utilicen antagonistas de TNF.
Evidencia y recomendaciones sobre el uso de la terapia biológica durante el embarazo y la lactancia
| Fármaco | Teratogen. (evidencia)* | Toxicidad feto, embarazada, parto, y recién nacido | Lactancia y neonato | Recomendaciones ficha técnica (AEMyPS) |
| Anti TNF-α | B | - Datos insuficientes en humanos- Sugerido síndrome VACTERL | - Datos insuficientes en humanos | - IFX:• No se recomienda durante el embarazo• Mujeres en edad fértil deben utilizar anticonceptivos eficaces y continuar su uso durante al menos 6 meses después del último tratamiento con IFX• No se debe amamantar durante al menos 6 meses tras el último tratamiento con IFX-ETN:• No se recomienda durante el embarazo ni lactancia• Mujeres en edad fértil deben ser advertidas para no quedarse embarazadas-Adalimumab:• No se recomienda durante el embarazo• Mujeres en edad fértil deben utilizar anticonceptivos eficaces y continuar su uso durante al menos 5 meses después del último IFX• No se debe amamantar durante al menos 5 meses tras el último ADA-Certolizumab pegol:• Actualmente no hay un posicionamiento concreto-Golimumbab:• No se recomienda durante el embarazo, solo si es estrictamente necesario• Mujeres en edad fértil deben utilizar anticonceptivos eficaces y continuar su uso durante al menos 6 meses después del último tratamiento con golimumab• No se debe amamantar durante al menos 6 meses tras el último tratamiento con golimumab |
| Anakinra | B | - Datos insuficientes en humanos | - Datos insuficientes en humanos | - No se recomienda durante el embarazo y la lactancia- Las mujeres en edad fértil deben utilizar anticonceptivos eficaces |
| RTX | C | - Niveles bajos o indetectables de linfocitos B (CD19+) en niños recién nacidos de madres con RTX | - Datos insuficientes en humanos | - No se recomienda el embarazo a menos que el beneficio supere el riesgo-Durante y hasta 12 meses después del tratamiento con RTX las mujeres en edad fértil deben usar métodos contraceptivos eficaces-No se debe amamantar durante el tratamiento con RTX ni durante los 12 meses siguientes a la última dosis de RTX |
| ABT | C | - Datos insuficientes en humanos | - Datos insuficientes en humanos | - No se recomienda el embarazo a no ser que sea claramente necesario- Durante y hasta 14 semanas después del tratamiento con ABT las mujeres en edad fértil deben usar métodos contraceptivos eficaces- No se debe amamantar durante el tratamiento con ABT ni durante los 12 meses siguientes a la última dosis de ABT |
| TCZ | C | - Datos insuficientes en humanos | - Datos insuficientes en humanos | - No se recomienda el embarazo salvo que sea claramente necesario- Durante y hasta tres meses después del tratamiento con TCZ las mujeres en edad fértil deben usar métodos contraceptivos eficaces-Valorar individualmente riesgo/beneficios de la lactancia y el uso de TCZ |
ABT: abatacept; ADA: adalimumab; ETN: etanercept; IFX: infliximab; RTX: rituximab; TCZ: tocilizumab; VACTERL: defectos vertebrales, atresia anorrectal, anomalías cardíacas, fístula traqueoesofágica con atresia esofágica, anomalías renales y defectos en miembros superiores.
*Clasificación de la FDA (U.S. Federal Drug Administration) sobre teratogenicidad de los fármacos: Categoría A: estudios adecuados y bien controlados no han logrado demostrar riesgo para el feto en el primer trimestre del embarazo y no existen pruebas de riesgo en trimestres posteriores. Categoría B: indica una de las siguientes posibilidades: a) En estudios sobre animales no ha existido manifestación teratógena, pero no ha sido confirmado en humanos; b) En estudios sobre animales se ha detectado un cierto potencial teratógeno, pero no ha podido ser confirmado en humanos. Categoría C: indica una de las siguientes posibilidades: a) En estudios sobre animales se ha detectado efecto teratógeno, pero aún no se ha ensayado en humanos; b) Aún no se han efectuado estudios (ni en animales ni en humanos). Categoría D: Se han efectuado estudios que demuestran efectos teratógenos sobre el feto humano, pero en ocasiones el beneficio obtenido con el empleo de estos medicamentos puede superar el riesgo esperado (uso en situaciones límite de posible muerte materna). Categoría X: medicamentos que han demostrado, indudablemente, poseer efectos teratogénicos manifiestos y cuyos riesgos superan con creces el posible beneficio a obtener.
En pacientes con terapia biológica que vayan a ser sometidos a cirugía mayor electiva, se aconseja suspender temporalmente dicho tratamiento (NE 4; GR C; GA 96%).
Aunque no existen datos concluyentes99–103, el panel recomienda suspender temporalmente la terapia biológica cuando el paciente va a ser sometido a una cirugía mayor programada. A pesar de que no existe un acuerdo universal sobre el intervalo de tiempo, alrededor de la cirugía, en que debe ser interrumpida la terapia, es conveniente que el médico tenga en consideración la diferente vida media (o duración del efecto inmunosupresor) del agente biológico utilizado para decidir el plazo concreto de interrupción del mismo. Tras la intervención, el panel considera que si no hay complicaciones o contraindicaciones se puede reinstaurar la terapia biológica a los 10-14 días.
InmigrantesPor otro lado, la terapia biológica puede favorecer, en pacientes provenientes de zonas endémicas, la activación y/o diseminación de ciertas infecciones, poco corrientes en nuestro medio104. Antes del inicio del tratamiento, la presencia en estos enfermos de síntomas cutáneos, digestivos, respiratorios, hematuria o eosinofilia, debe llevar a descartar la coexistencia de infecciones, fundamentalmente parasitarias105. En ausencia de síntomas, pero presencia de factores epidemiológicos de riesgo, hay que realizar una búsqueda de parásitos en heces, que si es positiva, estos deben erradicarse.
Especial interés suscita el caso del Strongyloides stercoralis (S. stercoralis), helminto de distribución tropical, subtropical, zonas del sur de Estados Unidos y cuenca mediterránea, incluyendo la española, capaz de permanecer en el huésped durante años y de causar graves cuadros de hiperinfestación y diseminación en pacientes imunodeprimidos106–108. En pacientes de riesgo debe realizarse estudio de heces para la detección de larvas. Se recomienda realizar tratamiento profiláctico con ivermectina 200μg/kg/día dos días seguidos, en los pacientes que hayan vivido, en cualquier momento de su vida, más de tres meses en una zona endémica para S. stercoralis, aunque la búsqueda en heces sea negativa. Algunos autores recomiendan repetir la misma pauta a los 15 días y otros solo en caso de que se hubieran detectado larvas inicialmente, comprobando posteriormente la desaparición de las larvas de las heces. En los pacientes españoles que vivan en la cuenca mediterránea, se considera factor de riesgo el hecho de trabajar descalzo en contacto con tierra húmeda109. Se puede utilizar como alternativa albendazol 400mg/12h durante 7 días.
Además, en estos pacientes siempre habrá que valorar el diagnóstico de hiperinfestación y diseminación en caso de complicaciones sistémicas y sepsis, considerando el tratamiento empríco con ivermectina intravenosa108.
Finalmente, a todos los que deseen viajar a zonas que puedan ser endémicas o donde la incidencia de infecciones sea alta y estén en tratamiento con terapias biológicas, se les debe urgir a ponerse en contacto con las autoridades sanitarias pertinentes para informarse.
ConclusionesLa SER ha elaborado en consensos previos distintas recomendaciones sobre la eficacia y seguridad del uso de las terapias biológicas en la AR, EspA y APs. Debido a la aparición de nuevas terapias biológicas y al gran volumen de información que disponemos actualmente, se ha decidido hacer un documento específico y separado de las recomendaciones sobre la gestión del riesgo del uso de la terapia biológica independientemente de la enfermedad de base.
Además, no cabe duda que es fundamental para una buena praxis el disponer de recomendaciones explícitas que abarquen todos los aspectos de la seguridad de estos tratamientos tal y como se han mostrado en este documento.
Volver a insistir en que la prescripción de medicamentos al margen de las indicaciones y recomendaciones de la autorización de comercialización correspondiente afecta a la responsabilidad profesional del médico.
FinanciaciónEste trabajo está financiado parcialmente con el Subprograma RETICS, RD08/0075 (RIER) del Instituto de Salud Carlos III (ISCIII), dentro del VI PN de I+D+i 2008-2011 (FEDER).
Conflicto de interesesEl Dr. Collantes ha recibido becas de investigación (5.000 €/persona año o más) de MSD, y honorarios por ponente (5.000 €/año o más) de Abbott. El Dr. Mulero, becas de investigación (5.000 €/persona año o más) de MSD y Pficer, Abbott. La Dra. García de Vicuña, becas de investigación (5.000 €/persona año o más) de MSD, Abbott, BMS, Roche. El Dr. Cañete, becas de investigación (5.000 €/persona año o más) de Abbott. Los doctores Batlle, Loza, Sanz, Linares, indican no tener conflictos de interés.