Las cardiopatías congénitas pueden presentar una anatomía difícil de interpretar. La ecocardiografía tridimensional aporta imágenes únicas sin necesidad de reconstrucción mental anatómica tan a menudo necesaria en la ecocardiografía bidimensional.
Material y métodosSe estudiaron 271 casos: 80 registros fetales y 191 transtorácicos. En todos se realizó ecocardiografía bidimensional (2D) y tridimensional (3D) (equipo Philips Sonos 7500, con sonda matricial) con cuatro modalidades de ecografía 3D: 3D tiempo real, biplano, color y volumen completo.
ResultadosEn los defectos septales, esta técnica definió de manera precisa el tamaño, la forma y los bordes. En los canales auriculoventriculares y anomalías mitrales determinó la anatomía y mecanismos de regurgitación y estenosis. En el cribado fetal permitió un estudio segmentario del corazón fetal.
ConclusionesLa ecocardiografía 3D en tiempo real es una técnica factible, sencilla y rápida. Aporta detalles anatómicos y funcionales esenciales en las cardiopatías congénitas. El rastreo fetal facilita un análisis segmentario completo del corazón fetal.
Anatomical comprehension of congenital cardiac diseases by 2D echocardiography is occasionally very difficult. 3D echocardiography provides a more spatial anatomical information avoiding the need of two-dimensional reconstruction.
MethodsOf the 271 cases studied 80 were foetal and 191 patients. In all cases, 2D and 3D echocardiography was performed (Sonos 7500 with matrix probe). Four modes of 3D imaging were used.
Results3D echocardiography gave an accurate description of the size, form and wedges of septals defects. In atrioventricular septal defects and mitral anomalies, 3D echocardiography was useful for the assessment of dynamic valve morphology and mechanisms of regurgitation. In foetal screening the segmentary heart study was carried out from a single acoustic window.
Conclusions3D real time echocardiography is a feasible, easy and rapid technique. It provides anatomical and functional details needed for an accurate comprehension of congenital cardiac diseases. In foetal screening, it provides an easier segmentary analysis of the entire foetal heart.
En las últimas décadas, la ecocardiografía ha sido la técnica no invasiva obligatoria en el estudio de las cardiopatías congénitas. Actualmente, la gran mayoría de los pacientes con cardiopatía congénita que precisan cirugía son intervenidos directamente a partir de los datos de la ecocardiografía. En los últimos años, la aparición de la ecocardiografía tridimensional (3D) en tiempo real, tras una larga investigación en la adquisición de este modo de imagen1, ha llevado a la práctica diaria una técnica sencilla y rápida que optimiza el estudio de las cardiopatías congénitas.
En este estudio descriptivo aportamos nuestra experiencia preliminar con la ecocardiografía 3D analizando las potenciales aplicaciones y avances de esta técnica, así como sus limitaciones en el estudio de las cardiopatías congénitas.
MATERIAL Y MÉTODOSDesde enero de 2005 hasta septiembre de 2006 se realizó ecocardiografía 3D en 271 casos: 80 estudios ecocardiográficos fetales y 191 transtorácicos.
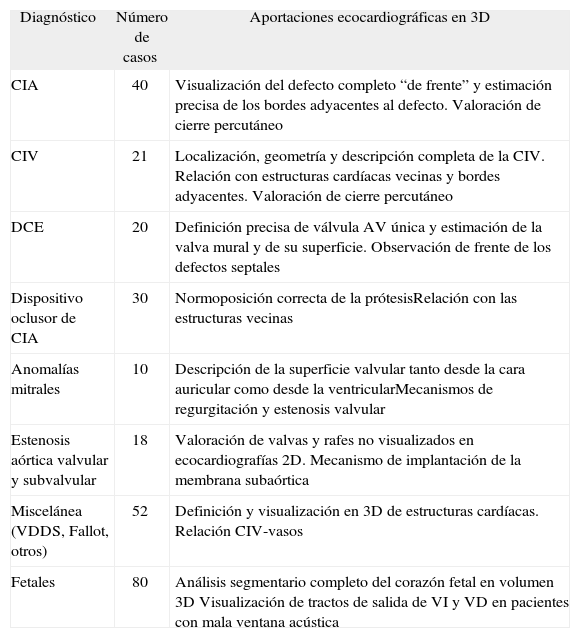
El espectro de las lesiones cardíacas incluyó desde defectos simples –comunicación interauricular (CIA), comunicación interventricular (CIV)– hasta cardiopatías complejas (tabla 1).
Aportación de la ecocardiografía tridimensional en cardiopatías congénitas
| Diagnóstico | Número de casos | Aportaciones ecocardiográficas en 3D |
| CIA | 40 | Visualización del defecto completo “de frente” y estimación precisa de los bordes adyacentes al defecto. Valoración de cierre percutáneo |
| CIV | 21 | Localización, geometría y descripción completa de la CIV. Relación con estructuras cardíacas vecinas y bordes adyacentes. Valoración de cierre percutáneo |
| DCE | 20 | Definición precisa de válvula AV única y estimación de la valva mural y de su superficie. Observación de frente de los defectos septales |
| Dispositivo oclusor de CIA | 30 | Normoposición correcta de la prótesisRelación con las estructuras vecinas |
| Anomalías mitrales | 10 | Descripción de la superficie valvular tanto desde la cara auricular como desde la ventricularMecanismos de regurgitación y estenosis valvular |
| Estenosis aórtica valvular y subvalvular | 18 | Valoración de valvas y rafes no visualizados en ecocardiografías 2D. Mecanismo de implantación de la membrana subaórtica |
| Miscelánea (VDDS, Fallot, otros) | 52 | Definición y visualización en 3D de estructuras cardíacas. Relación CIV-vasos |
| Fetales | 80 | Análisis segmentario completo del corazón fetal en volumen 3D Visualización de tractos de salida de VI y VD en pacientes con mala ventana acústica |
3D: tridimensional; CIA: comunicación interauricular; CIV: comunicación interventricular; DCE: defecto de cojines endocárdicos; VD: ventrículo derecho; VDDS: ventrículo derecho de doble salida; VI: ventrículo izquierdo.
Se utilizó el equipo ecocardiográfico Philips Sonos 7500 (EE.UU.) con sonda matricial (2-4MHz) con 3.000 elementos piezoeléctricos incorporados al transductor que confieren a la sonda una ergonomía aceptable para el examen cardíaco pediátrico. Se utilizaron cuatro formas de adquisición en la ecocardiografía 3D:
- 1.
3D en tiempo real. Permite la adquisición y visualización directa de un volumen cardíaco instantáneo de 40° × 20° con resolución máxima. Con este modo de ecocardiografía 3D es importante una cuidadosa manipulación de las ganancias ecocardiográficas. La colorización sepia ayuda a una mejor visualización volumétrica.
- 2.
Volumen total. Modo de adquisición en el cual se recogen cuatro subvolúmenes bajo sincronización electrocardiográfica. La suma de estos subvolúmenes permite un estudio completo del corazón. Con ganancias altas, el volumen presenta una dimensión de 60° × 60° La obtención del volumen total debe hacerse idealmente en apnea con el fin de reducir los artefactos originados por la respiración. Este modo de adquisición permite manipular la imagen obtenida a través de múltiples ejes de corte. Las medidas de superficie valvular, diámetro de defectos septales y volúmenes ventriculares deben realizarse en una estación de trabajo (Qlab) conectada al ecocardiógrafo.
- 3.
Doppler color. Modo de adquisición que requiere la obtención de siete subvolúmenes bajo monitorización electrocardiográfica; la suma de estos subvolúmenes constituye el volumen total. Se pueden estimar cortocircuitos o regurgitaciones valvulares una vez trasladados a la estación de trabajo.
- 4.
Biplano en tiempo real. La sonda matricial permite la captura de dos imágenes bidimensionales (2D) con ángulos de incidencia diferentes desde una única ventana acústica. La imagen de referencia puede rotarse hasta 180° sin modificar la posición del transductor, así como inclinarse verticalmente de −30 a +30°, y lateralmente, de −45 a +45° Este modo de adquisición permite la utilización del Doppler color.
En todos los pacientes se realizó un estudio 2D y un posterior estudio 3D con las mismas ventanas acústicas que el eco convencional.
RESULTADOSEntre enero de 2005 y septiembre de 2006 se realizaron un total de 271 estudios 3D: 80 fetales y 191 transtorácicos (v. tabla 1); el tiempo requerido para la adquisición tridimensional fue alrededor de 10min. Requirieron sedación 15 pacientes (7,8 % de los estudios transtorácicos). En 13 casos (6,8 %) no se pudo realizar el estudio debido a una ventana acústica inadecuada.
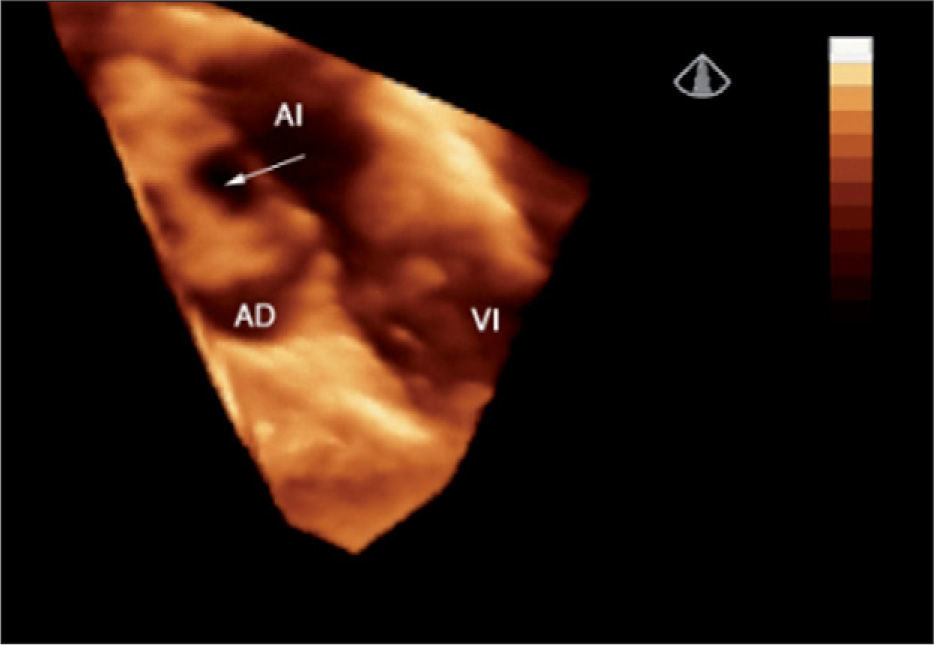
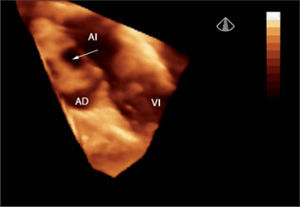
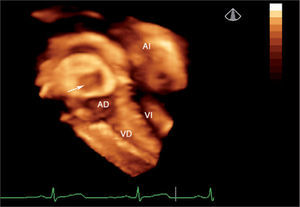
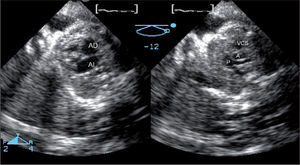
Defectos interauriculares tipo ostium secundum (40 casos). Se obtuvo la visualización del tabique interauricular “de frente” y el defecto en toda su extensión, tanto desde la aurícula derecha como desde la aurícula izquierda (fig. 1). Se requirió de manera detallada la geometría, la orientación espacial y la relación con estructuras vecinas. La valoración cualitativa de los bordes del defecto permitió una mejor selección de pacientes para un cierre percutáneo.
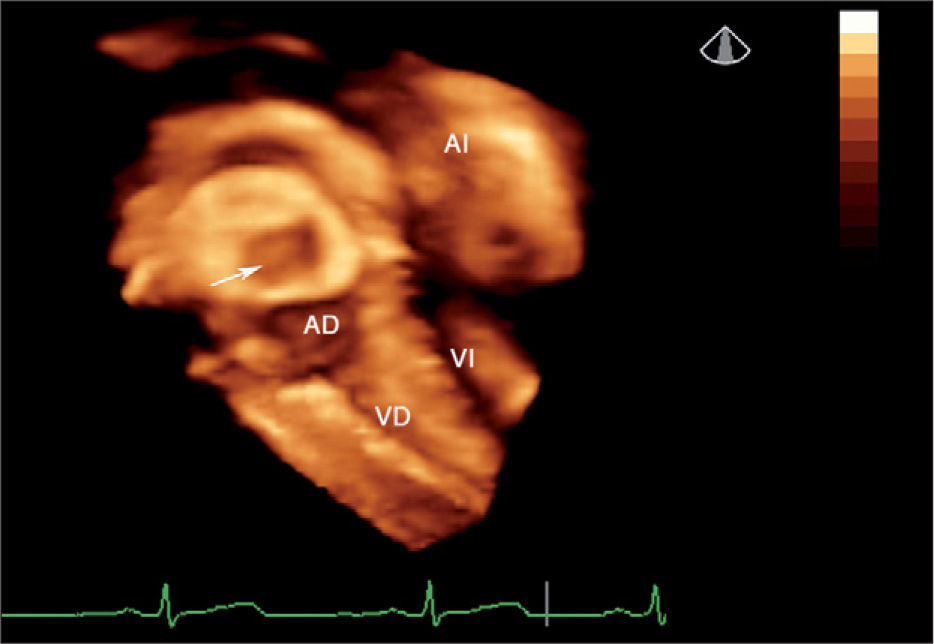
Después del cierre percutáneo, el ecocardiograma 3D permitió comprobar la normoposición de la prótesis y su relación con las estructuras vecinas (fig. 2).
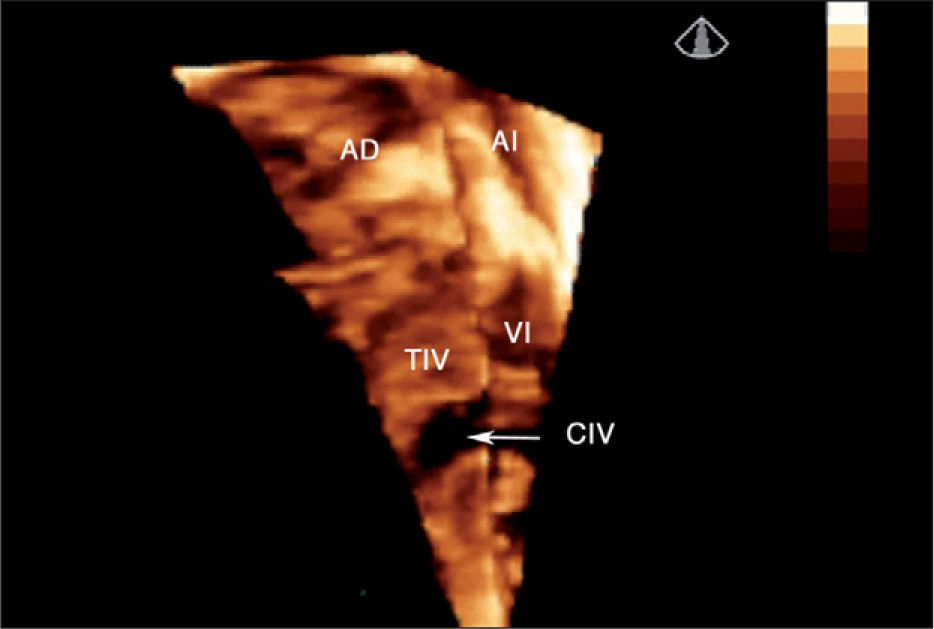
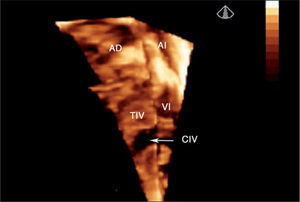
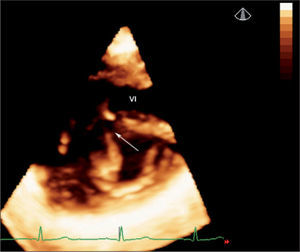
Defectos interventriculares (22 casos). Se analizó el tabique interventricular en toda su extensión, demostrando con precisión el tamaño, la geometría y la localización exacta del defecto (fig. 3). El estudio 3D sirvió para valorar la relación del defecto con vasos y válvulas auriculoventriculares; este dato es fundamental en el caso de cardiopatías complejas que precisan corrección quirúrgica. Fue especialmente útil la valoración de la CIV en el ventrículo derecho de doble salida para establecer el abordaje quirúrgico óptimo.
Ecocardiografía 3D en tiempo real de comunicación interventricular muscular grande visualizada desde el ventrículo derecho (flecha). Se aprecia toda la superficie del tabique interventricular (parte de la pared libre del ventrículo derecho se ha recortado para una mejor visualización del defecto). AD: aurícula derecha; AI: aurícula izquierda; CIV: comunicación interventricular; TIV: tabique interventricular; VD: ventrículo derecho; VI: ventrículo izquierdo.
En los casos en los que se consideró un posible cierre percutáneo de la CIV, se valoró el tamaño y los bordes del defecto, especialmente el borde aórtico.
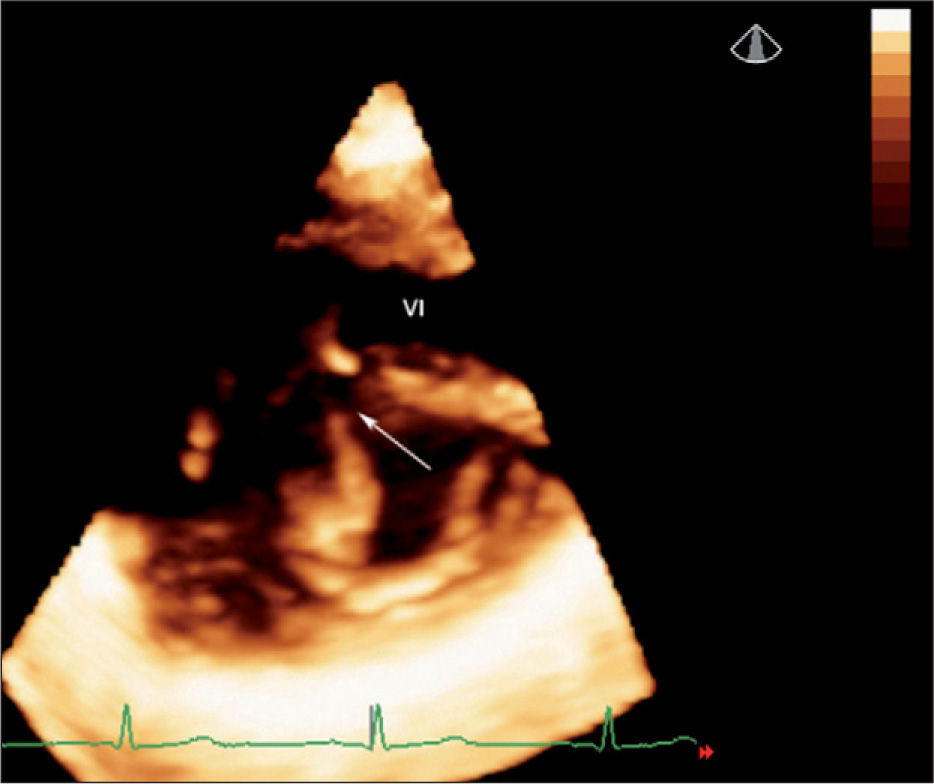
Valoración de las válvulas auriculoventriculares. Se estudió un total de 22 casos, de los cuales 15 presentaban un defecto auriculoventricular y siete, patología mitral aislada. En todos los casos se adquirieron imágenes que permitieron ver la válvula desde la aurícula izquierda y desde el ápex; la vista desde el ventrículo izquierdo fue la perspectiva más útil. Se estudió la forma, el movimiento y los mecanismos de regurgitación antes y después de la cirugía. La valva anterior, cleft y valva posterior fueron perfectamente analizados mediante ecocardiografía 3D (fig. 4).
Estenosis aórtica valvular y subvalvular (18 casos). Con la ecografía 3D se definió mejor la forma, el número de valvas y los distintos grados de fusión entre los rafes. En las estenosis subaórticas, en algunos casos, el tridimensional hizo el diagnóstico diferencial entre estenosis valvular y subvalvular en caso de membranas muy próximas a la válvula no claramente observadas mediante la ecocardiografía 2D.
Estudio ecocardiográfico tridimensional fetal. Se realizó ecocardiograma fetal a 80 pacientes con sospecha de cardiopatía con edad gestacional comprendida entre las 18 y las 34 semanas.
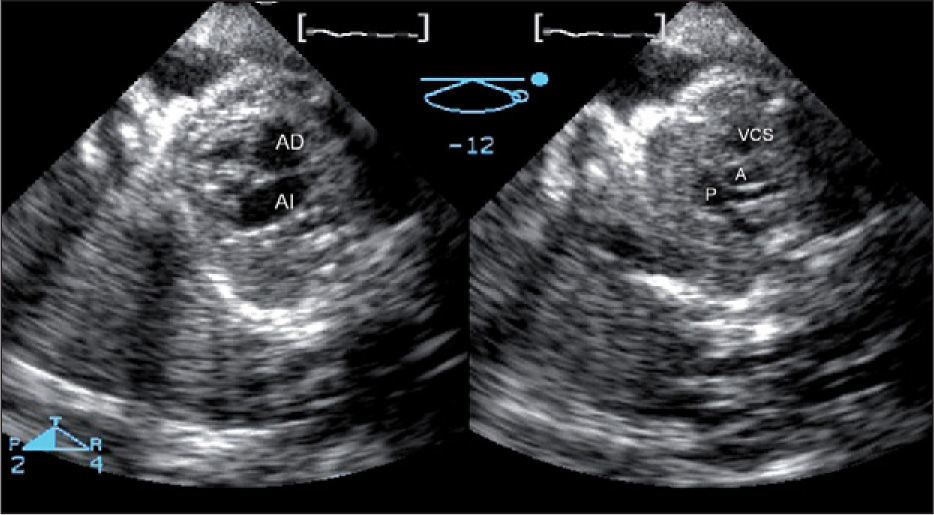
En todos los casos se realizó un estudio 2D, y un registro 3D con modo biplano (fig. 5), seguido de la adquisición de cuatro volúmenes tridimensionales del corazón fetal en tiempo real. Debido al pequeño tamaño del corazón fetal, fue posible incluirlo enteramente en el volumen sin necesidad de sincronización electrocardiográfica fetal. Se estudió la obtención de los nueve planos referidos por la American Society of Echocardiography2 para un examen óptimo del análisis cardíaco fetal desde la manipulación de un único volumen. Esta técnica aportó, respecto al ecobidimensional, un examen más completo, describiendo la concordancia aurículo-ventricular y ventrículo-arterial de forma más precisa que en el estudio 2D. La manipulación de los volúmenes tridimensionales en la estación de trabajo aportó un mayor número de planos cardíacos fetales requeridos por las guías anteriormente citadas para el examen cardíaco fetal.
Modo biplano fetal en un corazón normal. Desde una proyección apical, con cuatro cámaras y con una única ventana acústica, con una inclinación vertical, se ha obtenido simultáneamente el plano ecocardiográfico fetal “tres vasos” con la vena cava superior, aorta y pulmonar bifurcándose en sus dos ramas. A: aorta; AD: aurícula derecha; AI: aurícula izquierda; P: arteria pulmonar; VCS: vena cava superior.
La ecocardiografía 3D en tiempo real permite la visualización instantánea de la imagen y supera ciertas limitaciones de la ecocardiografia 2D en el estudio de las cardiopatías congénitas. Aporta una descripción exacta de las lesiones, como las CIA o CIV sin necesidad de realizar presunciones geométricas mentales, tan a menudo necesarias.
La aparición de la sonda matricial que permite el estudio en tiempo real supera los anteriores intentos de la ecocardiografía 3D, en los que se requería una reconstrucción digital de la imagen posterior al estudio3,4. Esto conllevaba una distorsión de la imagen y un gran consumo de tiempo. Esta nueva sonda transtorácica aporta, además, la posibilidad de realizar el estudio por personal no experto sin necesidad de sedar al paciente.
La combinación de múltiples proyecciones y cortes volumétricos 3D puede complementar (y en algunas ocasiones corregir) el diagnóstico realizado por la ecocardiografía 2D en las malformaciones cardíacas, especialmente en las malformaciones conotruncales que define mejor la relación del defecto interventricular y los grandes vasos.
Esta técnica aporta imágenes cardíacas similares a las que encuentra el cirujano permite un mayor entendimiento morfológico y funcional, favoreciendo el diálogo con profesionales menos experimentados en ecocardiografía 2D5. Existen trabajos recientes en la bibliografía que demuestran que el mayor rendimiento de la ecocardiografía 3D se encuentra en pacientes con cardiopatías congénitas y enfermedad valvular mitral6.
En los defectos septales interauriculares, a veces con geometría variable y compleja de difícil estudio, la ecocardiografia 3D permite observar el tabique “de frente” con una perspectiva completa del defecto. Su tamaño, geometría, localización y bordes se definen perfectamente, de tal manera que en algunos centros se considera como la técnica de referencia para la selección de pacientes, por ser una técnica no invasiva y rápida, tanto en la adquisición como en el análisis de la imagen, para cierre percutáneo. En la última década, se ha convertido en la técnica de elección como alternativa a la cirugía1,7,8. Una vez implantado el dispositivo, la visión 3D permite precisar su posición y la relación con estructuras vecinas9.
En los defectos septales interventriculares permite una descripción exacta de la localización, el tamaño y la dimensión del defecto. Se ha descrito una correlación elevada entre las medidas del defecto septal interventricular por ecocardiografia 3D y las obtenidas durante su cierre quirúrgico10. En los casos de clefts mitrales, según se ha publicado recientemente6, la ecocardiografía 2D permite la visualización de la anchura, pero no de la profundidad, mientras que en la ecocardiografía 3D la profundidad de la hendidura se aprecia al observarse la totalidad del velo anterior.
En las cardiopatías congénitas complejas (v. tabla 1) complementa11 (y en algunas ocasiones corrige) el diagnóstico realizado por la ecocardiografía 2D, estableciendo la relación entre la conexión aurícula-ventricular y ventrículo-arterial, así como la de los defectos septales con los vasos12.
En el estudio del corazón fetal, la aparición de esta nueva técnica supone un gran avance13,14. Con el modo biplano, en madres con sobrepeso o con problemas de ventana acústica y de mala posición fetal, a través de una única ventana acústica se obtienen planos simultáneos de incidencia diferentes que permiten una visualización sencilla y completa del corazón fetal. En el rastreo habitual de las 20 semanas de edad gestacional, el corazón fetal se adquiere de forma completa en el volumen 3D. Esto permite un estudio posterior a través de cortes en múltiples direcciones que definen y estudian estructuras cardíacas fetales difíciles de obtener en el estudio convencional, como, por ejemplo, el arco aórtico. Una de las mayores ventajas de este modo de ecocardiografía 3D fetal es que no requiere monitorización electrocardiográfica. La adquisición volumétrica del corazón fetal latiendo en tiempo real permite valorar la disfunción valvular fetal de manera superior a la ecocardiografía 2D, además de aportar información añadida sobre el tamaño del corazón y los movimientos septales. Una de las grandes ventajas de esta nueva técnica en el rastreo fetal de cardiopatías es que es rápida y que no depende tanto de la experiencia del ecocardiografista como las formas técnicas anteriores de estudio del corazón fetal15.
La aparición del modo color 3D es de gran interés, ya que aporta una visión tridimensional de los chorros regurgitantes en valvulopatías y facilita un cálculo preciso de las fracciones regurgitantes y el mecanismo exacto de regurgitación, prolapso o la falta de coaptación del componente valvular16.
Otra futura aplicación de esta técnica, no especificado en nuestros resultados, pero ya descrito por otros autores17–19, es la valoración de la función cardíaca por 3D obteniendo volúmenes de ventrículo izquierdo, masa y fracción de eyección, con resultados similares a los obtenidos por resonancia magnética o gammagrafía en pacientes con cardiopatía congénita, con futuras aplicaciones en la valoración de la función derecha.
Pese a todas estas aportaciones, la ecocardiografía 3D todavía presenta ciertas limitaciones en el estudio de las cardiopatías congénitas6. La miniaturización de la sonda, junto con el aumento de frecuencias de emisión de la misma, facilitarían su uso clínico diario. La calidad del Doppler color, todavía insuficiente, y el que no exista el Doppler pulsado son factores que limitan su empleo en ciertos pacientes, lo que obliga al clínico a realizar, además, el estudio 2D en todos los casos.
En conclusión, la aparición de la ecografía 3D en tiempo real con sonda transtorácica es una técnica factible, sencilla y rápida que mejora la comprensión anatómica y facilita la transmisión de información al cirujano y al hemodinamista. Por el momento, al no disponer de Doppler pulsado o continuo, es preciso el empleo combinado de la ecocardiografía 3D y 2D, aunque posiblemente la integración de nuevas aplicaciones permitirá cubrir todas estas áreas en un futuro no muy lejano. Es la única técnica de imagen que permite la visualización tridimensional del corazón latiendo en tiempo real. El viaje al interior del corazón ha comenzado.