El objetivo de este trabajo es la revisión, desde una perspectiva práctica, de aquellos aspectos farmacológicos de la buprenorfina sublingual (Subutex®) y buprenorfina-naloxona (Suboxone®) que más puedan interesar a los clínicos para el manejo de sus pacientes. Aunque existen ya varias revisiones al respecto, en este trabajo hemos tratado de seleccionar y, sobre todo, integrar información dispersa en la literatura.
BioquímicaLa buprenorfina es un opioide semisintético derivado de la tebaína. Fue desarrollado a principios de los años setenta en el contexto de una línea de investigación que buscaba un analgésico con menor potencial de abuso y menor toxicidad que la morfina. Estas propiedades de la buprenorfina, junto a la prolongada duración de su efecto, condujeron a Jasinski2 a investigar su utilidad en el tratamiento de la adicción a opiáceos. Su estructura molecular es muy similar a la de la morfina, pero difiere en la composición de dos de sus cadenas laterales, con propiedades no polares, lo que le confiere una mayor liposolubilidad. Estas características bioquímicas determinan las peculiaridades farmacocinéticas y farmacodinámicas que justifican su vía de administración y su utilidad en el tratamiento de los pacientes con dependencia de opiáceos.
FarmacocinéticaAbsorciónSe han realizado diferentes estudios farmacológicos para determinar la vía de administración óptima para alcanzar sus objetivos terapéuticos. Debido a su alta liposolubilidad, la buprenorfina se absorbe bien por vía oral-digestiva, pero su biodisponibilidad es muy baja por la vía oral (inferior al 20%), ya que sufre un intenso metabolismo de «primer paso hepático», por lo que se considera una vía poco útil en la práctica clínica3.
La vía sublingual presenta una biodisponibilidad superior (entre un 30 y un 55%), dependiendo ésta de dos factores; por un lado, del tiempo de contacto del fármaco con la mucosa oral y, por otro, de la formulación galénica (la biodisponibilidad de la preparación líquida es un 50% superior que la de los comprimidos)4. Las ventajas de esta vía vienen dadas por la evitación del denominado «primer paso hepático» (por tanto, por la reducción de su rápida metabolización), por la minimización de los efectos secundarios como la sedación o el estreñimiento, debido a sus menores niveles plasmáticos relativos, y por su rápida absorción determinada por alta liposolubilidad.
Los principales inconvenientes de la vía sublingual son su relativo mal sabor y una amplia variabilidad intersujetos respecto a su biodisponibilidad. Se ha constatado que la buprenorfina tiene, en primer lugar, una rápida absorción desde su localización sublingual hasta el interior de la mucosa, seguida de un segundo paso relativamente más lento desde este nivel hasta el torrente circulatorio. Este «reservorio mucoso sublingual» es uno de los factores que contribuyen a que la duración de acción de la buprenorfina por esta vía sea superior que la de dosis equivalentes por vía intravenosa o intramuscular5.
En la actualidad, está aprobada la formulación de comprimidos sublinguales de buprenorfina de 2 y 8 mg para el tratamiento de pacientes con dependencia de opiáceos (Subutex®). Recientemente se ha aprobado dentro de la Unión Europea por EMEA (http://eu-ropa.eu/agencies/community_agencies/emea/index_es .htmun) un nuevo preparado de administración sublingual compuesto por buprenorfina y naloxona (Suboxone®), que confiere una mayor seguridad en caso de autoadministración endovenosa. Dicho preparado está disponible en dos formulaciones, 2 mg de buprenorfina y 0,5 mg de naloxona, y 8 mg de buprenorfina y 2 mg de naloxona.
Por vía sublingual, la naloxona tiene una biodisponibilidad prácticamente nula y un marcado efecto de primer paso hepático. Por ello, mientras que por vía sublingual dosis equivalentes de Subutex ® y Suboxone® tienen la misma eficacia, en caso de administración intravenosa de un preparado de Suboxone®, el efecto antagonista de la naloxona se pone de manifiesto. Con ello se disminuye el potencial de abuso de este fármaco, y por tanto mejora su seguridad y disminuye su derivación al mercado clandestino. La adición de naloxona no modifica significativamente el perfil farmacocinético de la buprenorfina6,7.
La formulación en comprimidos sublinguales ofrece algunas ventajas sobre la preparación líquida, tales como una mayor estabilidad del producto, una mayor facilidad de almacenamiento y distribución de los envases, así como una mayor facilidad de administración. El efecto de la buprenorfina por vía sublingual aparece ya en la primera hora tras su administración, y las concentraciones plasmáticas pico se suelen alcanzar unos 90 minutos después de su administración.
Se han investigado otras vías de administración, pero tienen menos interés práctico. Existe un preparado de administración de buprenorfina en bajas dosis para el tratamiento del dolor por vía transdermal, no obstante, los niveles plasmáticos alcanzados son «muy bajos» para el tratamiento de consumidores de heroína. Se ha estudiado la vía intranasal, con una biodisponibilidad elevada, sin embargo, presenta algunos problemas para su administración rutinaria3. Finalmente, en la actualidad se está investigando la utilidad de un preparado de liberación sostenida (inyección depot), pero aún hay pocos datos al respecto8.
DistribuciónLa buprenorfina se une en un 96% a las proteínas plasmáticas (principalmente alfa y beta globulinas), presentando un volumen de distribución relativamente grande (2,5 l/kg). Se distribuye inicialmente a tejidos y órganos muy vascularizados, como el hígado y el cerebro, para pasar posteriormente a la grasa corporal, gracias a su alta liposolubilidad. Debido también a esta propiedad, la buprenorfina atraviesa bien la barrera hematoencefálica, alcanzando concentraciones relativamente altas a este nivel. Durante la administración mantenida de una dosis de 8 mg/día, el estado estacionario se corresponde, aproximadamente, con una concentración plasmática de 0,8 ng/ml3.
MetabolismoLa buprenorfina se degrada, principalmente, en las paredes intestinales y en el hígado en un proceso de dos pasos. En primer lugar, una reacción de d-alquila-ción (14-N-desalquilación) catalizada por el citocromo P450 3A4 transforma la buprenorfina en norbuprenorfina. Posteriormente, tanto las moléculas de buprenorfina como las de norbuprenorfina experimentan un proceso de glucuronoconjugación. La norbuprenorfina es un metabolito con cierta actividad farmacológica y, aunque parece prolongar el tiempo de actuación del fármaco, su papel es moderado en este sentido (su efecto analgésico se estima en una quinta parte del efecto de la buprenorfina)9. La naloxona administrada por vía sublingual sufre un intenso primer paso hepático y es metabolizada principalmente por glucuronoconjugación.
El Cyp 3A4 constituye el 30% del total de los cito-cromos P450 hepáticos. Todos los fármacos que actúen como sustratos de este complejo enzimático van a producir interacciones farmacológicas de significación clínica variable. Así, los fármacos inhibidores selectivos de la recaptación de la serotonina (por ejemplo, fluvoxamina) y los antirretrovirales como el ritonavir o el indinavir, debido al efecto de inhibición enzimática que producen, aumentarán los niveles plasmáticos de la buprenorfina10.
ExcreciónEl 70-90% de la dosis administrada es eliminada por vía biliar en forma de glucurónidos. Tras la hidrólisis de estos derivados por la flora intestinal, la buprenorfina y norbuprenorfina libres retornan a la circulación enterohepática11. Una pequeña parte es eliminada por la orina, donde puede detectarse aún pasados unos días. Es necesario emplear un test específico para determinar la presencia de buprenorfina en orina, ya que el test general para opiáceos establece un cribado para metabolitos de la morfina y no tiene reactividad cruzada para buprenorfina y norbuprenorfina12. La naloxona es excretada principalmente por vía urinaria.
La buprenorfina parece seguir un modelo farmacocinético de tipo bicompartimental con un amplio volumen de distribución10. La circulación entero-hepática y la movilización del fármaco desde los depósitos grasos al torrente circulatorio parecen contribuir a que la vida media total de este fármaco esté entre las 20-32 horas.
FarmacodinámicaLa buprenorfina tiene una afinidad variable por cada uno de los subtipos de los receptores opioides.
Sobre el receptor μSobre este receptor μ, la buprenorfina muestra una alta afinidad y actúa como un agonista parcial. Es decir, tiene una elevada afinidad por el receptor, pero su actividad intrínseca es relativamente baja. La molécula de buprenorfina se disocia muy lentamente del receptor μ, lo que también contribuye a prolongar la duración del efecto de este fármaco. Tiene una menor actividad intrínseca que los agonistas completos como la heroína o la metadona, lo que conduce al denominado «efecto techo» (ceiling effect)13. Su metabolito, la norbuprenorfina, tiene muy baja actividad intrínseca sobre este receptor, aunque, en relación con la buprenorfina, tiene mayor tendencia a inducir depresión respiratoria (debido a su acción sobre receptores μ en el tejido pulmonar).
Como agonista parcial, el efecto máximo producido por la buprenorfina será siempre menor que el producido por un agonista completo como la heroína o la metadona en dosis equivalentes. Dicho de otra forma, para producir un determinado efecto con la buprenorfina será necesario ocupar un número mucho mayor de receptores μ que para producirlo con la morfina.
El perfil singular de la buprenorfina como agonista parcial μ y antagonista le proporciona algunas ventajas sobre los agonistas completos, tales como una mayor seguridad relativa respecto a su capacidad de inducir depresión respiratoria, una menor sintomatología sobre el sistema nervioso autonómo durante la abstinencia, y menos efectos disfóricos. Se ha propuesto que en la administración de buprenorfina en dosis relativamente bajas predominaría el efecto agonista parcial sobre los receptores μ, mientras que en dosis altas el efecto sobre los receptores compensaría el efecto μ y sería el responsable de la forma especial de su curva dosis-respuesta14.
En pacientes con intolerancia a los opiáceos, la buprenorfina se comporta como un agonista opioide, aunque su efecto siempre será menor que el de ellos. Sin embargo, en pacientes consumidores de otros opiáceos como heroína o metadona, la administración de buprenorfina mostrará una cierta capacidad de actuar como antagonista15 (por una parte, por su alta afinidad al receptor μ desplazaría de su unión al receptor μ a otros agonistas opiodes, y, por otra parte, por su acción agonista parcial con menor poder agonista que los agonistas opiodes plenos, el efecto final podría ser de un cierto grado de antagonismo).
Tras un tratamiento prolongado con buprenorfina, al igual que con metadona, se produce una desensibilización de los receptores μ en casi todas las vías del sistema opioide. Sin embargo, la desensibilización producida por la buprenorfina es menor que la desencadenada por el tratamiento con agonistas completos. Por otro lado, la capacidad de la buprenorfina para activar el receptor μ (por inhibición de la adenilciclasa) es menor que en el caso de los agonistas completos16. Se ha propuesto que estas dos propiedades podrían contribuir a reducir el nivel de neuroadaptación en pacientes que son transferidos desde el tratamiento con metadona al de buprenorfina.
Sobre el receptorLa acción sobre estos receptores es compleja, ya que es antagonista de los receptores 2 y agonista de los 1 y 3. El antagonismo 2 se ha asociado a un relativo efecto antidepresivo y a la ausencia relativa de la disforia producida por los opiáceos agonistas de este subtipo de receptor, tales como la etorfina o la pentazocina. El agonismo 1 y 3 se ha asociado al efecto analgésico mediado a nivel espinal3.
Sobre el receptorLa buprenorfina tiene una baja afinidad por este receptor, lo que explicaría, en parte, la ausencia del «subidón» (high) percibido tras su consumo3.
Bases farmacodinámicas del manejo clínico de la buprenorfina para el tratamiento de la adicción a opiáceosEfectos de la buprenorfina sobre pacientes sin dependencia física (neuroadaptación) de opiáceosCuando se administran dosis agudas (aisladas) de buprenorfina por distintas vías, a pacientes que no consumen opiáceos o con consumos pequeños y esporádicos, estas personas experimentan los efectos objetivos y subjetivos típicos de las sustancias opioides con actividad agonista μ (por ejemplo, sedación, euforia y apetencia o gusto por la sustancia)17.
Cuando se administran dosis sucesivas de buprenorfina (dentro de un rango de dosis relativamente bajo) se observa una relación dosis-efecto opioide (sedación y euforia). El efecto máximo opioide aparece con dosis de 16 a 24 mg/día (aunque existe una amplia variabilidad interindividual). Este efecto máximo producido por estas dosis de buprenorfina puede corresponderse, grosso modo, con el efecto producido por una dosis de 60 mg de metadona por vía oral o 30 mg de morfina por vía parenteral.
Sin embargo, cuando administramos dosis más altas de buprenorfina (a partir de 32 mg/día), no se produce un incremento de los efectos opioides («efecto techo» del efecto agonista opiáceo). Esto se debe a que, a partir de estas dosis, empieza a manifestarse, más claramente en una persona no consumidora de opiáceos, el efecto agonista parcial (y ya no el «agonista» que se observa más con dosis más bajas de buprenorfina). Es decir, debido a su alta afinidad por el receptor μ y a su baja actividad intrínseca, la buprenorfina no llega a desencadenar los efectos opioides con la misma intensidad que los agonistas completos como la metadona o la heroína. Esto se ha venido a denominar «efecto techo» (ceiling effect)17.
Los efectos fisiológicos de la buprenorfina son los típicos de cualquier fármaco opiáceo tales como miosis, disminución de la motilidad intestinal, retención urinaria y depresión respiratoria. Sin embargo, al igual que con los efectos subjetivos de este fármaco (sedación y euforia), los efectos fisiológicos también tienen una curva aplanada a medida que se incrementan las dosis de buprenorfina.
De todo ello pueden extraerse dos consecuencias de índole práctica. Por un lado, es evidente que la buprenorfina tiene efectos opioides agudos cuando se administra de forma ocasional, sobre todo en sujetos no dependientes de opiáceos, por lo que puede tener un cierto potencial de abuso. Pero por otro lado, y dadas sus características de agonista parcial, su potencial de abuso es relativamente bajo, sobre todo entre consumidores habituales de heroína, al tiempo que el margen de seguridad es mayor (sobre todo en relación con su capacidad de inducir depresión respiratoria).
La observación de que la administración de dosis relativamente altas de buprenorfina se asocia a una duración prolongada del efecto, junto a un bajo riesgo de intoxicación y depresión respiratoria, ha llevado a proponer un régimen de administración a días alternos18.
Efectos de la buprenorfina sobre pacientes con dependencia de opiáceosLa buprenorfina puede producir una amplia variedad de efectos farmacodinámicos (por ejemplo, efecto «tipo agonista» o efecto «tipo agonista-parcial antagonista») dependiendo de distintos factores, tales como el nivel de dependencia física subyacente (neuroadaptación), el tipo de opiáceo que el paciente viene consumiendo (por ejemplo, heroína, metadona, buprenorfina, etc.), el tiempo transcurrido desde la última dosis del opiáceo y la primera dosis de buprenorfina, así como la primera dosis de prueba de buprenorfina.
Se ha demostrado que la buprenorfina tiene la capacidad de reducir y suprimir significativamente la sintomatología de abstinencia de opiáceos, tanto frente a placebo como frente a agonistas α2 adrenérgicos como la clonidina. Para que esto sea posible, las dosis del opiáceo previo han de ser bajas o moderadas (y más exactamente, sus niveles plasmáticos)19.
Por otro lado, la buprenorfina puede inducir síntomas de abstinencia en pacientes que tomaban previamente dosis de metadona relativamente altas o bien cuando ha transcurrido relativamente poco tiempo desde la última dosis de metadona hasta la primera dosis de buprenorfina. Esto se debe a la propiedad de la buprenorfina como agonista parcial. Se postula que la buprenorfina, con mayor afinidad por el receptor opioide que la metadona, «desplazaría» a ésta de su localización, pero al tener menor actividad intrínseca que un agonista completo, el paciente experimentaría un síndrome de abstinencia «inducido»20.
La probabilidad de inducir un síndrome de abstinencia de opiáceos (SAO) depende de la dosis de metadona previa que toma el paciente y de la dosis inicial de buprenorfina. Así, dosis iniciales de buprenorfina de 4 mg pueden inducir SAO en un paciente que tomaba previamente 60 mg/día de metadona, y no producirlo en la mayoría de los casos de pacientes que tomaron 30 mg/día de este agonista. Por otro lado, una misma dosis de buprenorfina puede inducir SAO si se administra dos horas después de tomar su dosis previa de meta-dona y no inducirlo si la primera dosis de buprenorfina se administra 24 horas después. Los protocolos de inducción tienen en consideración ambas condiciones simultáneamente. Así, en el caso de que el paciente tome previamente metadona, se suele realizar el cambio desde 30 o 40 mg/día de metadona, se suele esperar algo más de 24 horas desde la última toma (cuando comiencen a aparecer algunos síntomas leves de abstinencia) y entonces se administran entre 2 y 4 mg de buprenorfina.
Otro factor a tener en cuenta en el inicio del tratamiento del paciente es su peso o, más concretamente, su índice de masa corporal (IMC). Los pacientes más obesos tienden a mantener durante más tiempo niveles plasmáticos de metadona más altos con relación a pacientes más delgados que tomen las mismas dosis (debido a que este fármaco sigue un modelo farmacocinético de tipo bicompartimental). Por esta razón, pacientes con dosis de metadona previas de 40 mg/día e IMC alto pueden experimentar SAO tras tomar de 4 mg de buprenorfina, mientras que pacientes con menor IMC no lo experimentarían tomando las mismas dosis de ambos opiáceos17.
Cuando el tratamiento con buprenorfina se realiza sobre pacientes que tomaban previamente heroína, en vez de metadona, los parámetros anteriores varían, ya que la vida media de la heroína es menor que la de la metadona. En este caso, no es necesario esperar tanto tiempo desde la última dosis de heroína y la primera de buprenorfina. No obstante, hay que tener en cuenta que si se administra inicialmente una dosis relativamente alta de buprenorfina, puede desencadenarse también un SAO inducido.
Desarrollo de tolerancia cruzada o efecto de «bloqueo opioide»Dole, Nyswander y Kreek21 plantearon, ya desde del comienzo del desarrollo de los tratamientos con meta-dona, que una dosis eficaz para la reducción del consumo de heroína era aquella que lograba alcanzar la tolerancia cruzada. En estas circunstancias, si el paciente consumía dosis adicionales de heroína, apenas experimentaría los efectos de sedación y euforia, lo que conduciría a una reducción del consumo de heroína. Estos autores denominaron este fenómeno «bloqueo opioide» o «bloqueo narcótico» (narcotic blockade)21.
Se postula que la capacidad y la eficacia de la buprenorfina para reducir el consumo de heroína se fundamenta en este mismo fenómeno de «bloqueo opioide», aunque el mecanismo molecular es más complejo que en el caso de la metadona, debido a la propiedad de agonista parcial de la buprenorfina.
Dosis de buprenorfina necesaria para alcanzar el «bloqueo opioide»
Se ha sugerido que este efecto se alcanzaría con dosis relativamente altas de buprenorfina, lo que se asociaría a una mayor probabilidad de reducir el consumo continuado de heroína. En un estudio se comprobó que la capacidad de alcanzar el «bloqueo» para determinadas cantidades de heroína era mayor si se administraban dosis de 16 mg/día, que si se daban 8 mg/día. Otro trabajo indicó que dosis inferiores a 8 mg/día no eran capaces de inducir bloqueo y, por tanto, de proteger frente al consumo de heroína. No obstante, este bloqueo era remontable si las dosis de heroína adicionales eran superiores. La eficacia del «bloqueo opioide» ha sido demostrada tanto para los comprimidos de buprenorfina22 como para los de buprenorfina-nalo-xona23.
Duración del tratamiento con buprenorfina para alcanzar el «bloqueo opioide»
Al menos dos estudios han sugerido que, en pacientes en tratamiento continuado con buprenorfina, la capacidad de inducir «bloqueo» se adquiere ya desde la primera dosis15,24.
Duración del «bloqueo opioide» producido por una determinada dosis de buprenorfina
Algunos estudios sugieren que la duración del «bloqueo» tras la retirada de la buprenorfina es de 24 horas si el paciente venía tomando 2 mg/día, mientras que persistía hasta 5 días si el paciente tomaba dosis de 8 mg/día24,25. De todos modos, al igual que en los tratamientos con metadona, el ajuste de dosis de buprenorfina ha de ser individualizado, no existiendo dosis altas o bajas de forma arbitraria, sino dosis adecuadas.
Características de la neuroadaptación inducida por la buprenorfinaDebido a la propiedad de la buprenorfina como agonista parcial, el grado de neuroadaptación (dependencia física) inducido por este fármaco es menor que el observado en pacientes en tratamiento con metadona. Esto se ha puesto de manifiesto, experimentalmente, mediante la provocación de síntomas de abstinencia tras la administración de un antagonista de los receptores opiáceos como la naloxona. Así, las dosis de naloxona necesarias para precipitar un cuadro de abstinencia a buprenorfina son diez veces mayores que las necesarias para inducirlo en pacientes en tratamiento con 30 mg/día de metadona. Se piensa que esto es debido a la alta afinidad de la buprenorfina por el receptor opioide26,27.
No obstante, desde un punto de vista clínico práctico, tienen más interés las características de la abstinencia espontánea a la buprenorfina. Se ha constatado que el síndrome de abstinencia a la buprenorfina tiene un inicio tardío (incluso varios días después de su retirada brusca) y su intensidad es descrita como leve o moderada. Si la retirada de la buprenorfina es gradual, como suele hacerse en el contexto de los programas de tratamiento, no suele observarse una sintomatología de abstinencia clínicamente relevante17.
Fundamentos farmacocinéticos y farmacodinámicos de la combinación de buprenorfina y naloxona con ratio 4:1 (Suboxone®)La combinación de buprenorfina y naloxona en un mismo comprimido sublingual (Suboxone®), tiene por objetivo mantener la eficacia de los comprimidos dosisequivalentes de buprenorfina sola (Subutex®), al tiempo que disminuye su potencial de abuso en caso de autoadministración por vía parenteral (por precipitación de síntomas de abstinencia a opiá28, 29. Esto se debe al diferente perfil farmacológico de ambos productos. Por un lado, la naloxona tiene una escasa absorción y biodisponibilidad por vía sublingual (en torno al 9%)5 pero elevada por vía endovenosa24.
Una formulación óptima de buprenorfina y naloxona debería permitir alcanzar los objetivos anteriormente citados de forma segura y eficaz. No debemos olvidar que durante la abstinencia de opiáceos se desencadena una activación simpática con elevación de la tensión arterial y aumento de la frecuencia cardíaca. Por ello se han llevado a cabo un número elevado de estudios tanto en pacientes consumidores con dependencia de opiáceos establecida, como en personas no dependientes30. Para ello se emplearon distintas dosis de la combinación de buprenorfina/naloxona con diferentes ratios (sobre todo 2/1, 4/1 y 8/1). El preparado con ratio 2/1 fue el que precipitó el síndrome de abstinencia de mayor intensidad por administración endovenosa, mientras que la combinación 8/1 fue la que dio lugar al síndrome más leve. Finalmente, la elección de la combinación de 4 partes de buprenorfina y una de naloxona (4/1) permitía mantener la eficacia de la dosis correspondiente de buprenorfina y, a la vez, inducir un síndrome de abstinencia suficiente pero seguro. Dicho de otro modo, aparecería un cuadro de abstinencia asociado al bloqueo del refuerzo positivo de la buprenorfina pero, a la vez, no demasiado intenso como para producir una activación adrenérgica importante. Con ello, se reduciría el potencial de abuso de la combinación y, de forma secundaria, su derivación al mercado clandestino.
Evidencias sobre la eficacia y la efectividad de la buprenorfinaHay un gran número de trabajos que documentan la eficacia y la efectividad de la buprenorfina para el tratamiento de la dependencia de opiáceos31,32. Los diferentes estudios han tratado de evaluar los resultados de este fármaco tanto frente a placebo como frente a otros opiáceos (fundamentalmente metadona, aunque también respecto del LAAM). No obstante, también se han realizado algunos estudios que evaluaron su utilidad en la desintoxicación de pacientes consumidores de metadona. Más recientemente se han analizado otras variables como la calidad de vida relacionada con la salud, así como indicadores farmacoeconómicos. Dado el gran número de trabajos que aportan evidencias sobre algún aspecto concreto de la eficacia de la buprenorfina y los objetivos de este artículo, sólo consignamos las conclusiones más destacadas. Existen excelentes revisiones previas que abordan esta materia con más extensión31,32,33.
Una cuestión importante en la interpretación de los estudios sobre la eficacia de este fármaco es la fórmula galénica empleada en los mismos. En los primeros trabajos, de corte más experimental, se empleó una solución alcohólica líquida de buprenorfina para su administración sublingual. Sin embargo, los estudios realizados con posteridad emplearon el producto ya comercializado (en forma de comprimido sublingual). Se ha podido constatar que la biodisponibilidad del comprimido sublingual supone el 50% de la de la solución alcohólica de este producto, por lo que en la valoración adecuada de la eficacia de determinadas dosis de buprenorfina habrá de tenerse en cuenta este hecho.
Eficacia frente a placeboSe han realizado varios ensayos clínicos aleatorios en los que se ha comparado la buprenorfina, tanto en dosis fijas como individualizadas, frente a placebo34-38. En todos ellos se muestra una clara ventaja del tratamiento con buprenorfina en términos de reducción del consumo y retención en tratamiento. Los períodos de seguimiento de los principales estudios oscilan entre 2 y 52 semanas.
Eficacia frente a metadonaAunque algunos autores han estudiado la eficacia de la buprenorfina frente al LAAM39, la mayoría de los trabajos comparativos se han realizado frente a metadona, por ser el principal opiáceo utilizado como tratamiento.
Los primeros ensayos clínicos compararon buprenorfina en solución alcohólica (dosis comprendidas entre 2 y 16 mg/día) con metadona oral (dosis comprendidas entre 20 y 90 mg/día)40-44. Globalmente, los resultados fueron similares en términos de reducción en el consumo y de retención en el programa, si bien algunos trabajos mostraron mejores resultados con más de 65 mg/día de metadona que 12 o 16 mg/día de buprenorfina. Hay que tener en cuenta que estos trabajos comparaban dosis fijas de uno o ambos fármacos o bien el rango de flexibilidad de dosis empleado era muy estrecho.
Uehlinger et al45 emplearon por primera vez en un ensayo clínico la buprenorfina en forma de comprimidos de absorción sublingual. Compararon dos grupos de tratamiento con diferentes dosis flexibles e individualizadas (dentro de un límite prefijado): buprenorfina en dosis comprendidas entre 4 y 16 mg/día y metadona entre 30 y 120 mg/día. No se observaron diferencias significativas entre ambos grupos respecto de la reducción del consumo de heroína, aunque el grupo de tratamiento con metadona presentó una mayor retención.
Otras evidencias de efectividadComo decíamos antes, son muchos los trabajos realizados que han venido aportando evidencias sobre distintos aspectos del tratamiento con buprenorfina. En este apartado sólo reseñamos los más significativos desde el punto de vista clínico.
Distintos trabajos han evaluado la eficacia y la seguridad de la buprenorfina administrada en días alternos, en vez de diariamente18,46,47. Esta pauta se fundamenta en la larga duración de acción de la buprenorfina y el lento inicio de la sintomatología de abstinencia tras una eventual interrupción brusca de este fármaco. Las dosis administradas suelen ser el doble de su dosis habitual. Por ejemplo, si un paciente venía tomando 8 mg diariamente, pasaría a tomar 16 mg cada dos días. El interés de esta pauta se basa en la posibilidad de reducir el número de veces que el paciente tiene que acudir a la recogida de sus dosis, con la consiguiente reducción en costes directos e indirectos, siendo por otro lado innecesario dar al paciente dosis para llevar a casa (take-home) con la disminución de su derivación al mercado negro. Naturalmente, esta pauta sólo tiene sentido si se administra a los pacientes que acuden diariamente a la recogida del fármaco, resultando inecesaria si el paciente tiene autorización para su recogida semanal o quincenal en el punto de dispensación. Los estudios realizados no observan diferencias significativas entre la pauta diaria y la de días alternos respecto a los síntomas de abstinencia, aunque entre los pacientes que reciben buprenorfina en días alternos se observa un mayor número de urinoanálisis positivos a opiáceos. No obstante, estos resultados son similares a los observados entre los pacientes que no acuden diariamente a la recogida de sus dosis de buprenorfina.
Recientemente, otros trabajos han tratado de evaluar la efectividad de la buprenorfina en términos de calidad de vida relacionada con la salud48,49. En este estudio, se ha seguido a una cohorte de 53 pacientes que iniciaron tratamiento con buprenorfina (n = 29) o con metadona (n = 24). A los 3 años del comienzo del tratamiento, la retención para el grupo de metadona fue del 50% y del 45% para el grupo de buprenorfina, siendo comparables los valores del indicador general de calidad de vida. Los pacientes que recibieron tratamiento con buprenorfina tuvieron significativamente menos molestias gástricas, así como menos sensación de fatiga y cansancio, que los que recibieron tratamiento con metadona. El consumo de benzodiacepinas también fue significativamente menor en el grupo de tratamiento con buprenorfina.
Por otro lado, distintos autores han realizado estudios de evaluación económica de los tratamientos con buprenorfina, sobre todo en relación con metadona. En una reciente revisión al respecto, se concluye que, aunque la metadona es la alternativa más barata y más eficaz, cuando se comparan las ratios coste/efectivi-dad de ambos tratamientos no se observan diferencias significativas entre ellos50.
Perfil general de seguridad de la buprenorfinaEfectos adversos propios de buprenorfinaLos estudios que describen el perfil de efectos adversos de buprenorfina suelen referir tanto los efectos de tipo agonista (estreñimiento, náuseas, retención urinaria, sedación, etc.), como los debidos a una cierta abstinencia (cefalea, insomnio, dolor abdominal o malestar subjetivo). Estos efectos se han observado tanto en pacientes con tolerancia a los opiáceos, como en sujetos consumidores esporádicos. Ninguno de estos efectos representa un riesgo médico significativo y pueden manejarse clínicamente sin dificultad.
Depresión respiratoriaLas características de la buprenorfina como agonista parcial sobre el receptor opiode μ, con una actividad intrínseca relativamente baja, le dotan de una mayor seguridad frente a una potencial depresión respiratoria central que la metadona y el LAAM. Ya hemos citado anteriormente que existe una relación entre las dosis de buprenorfina y el efecto que puede modelizarse mediante una curva «aplanada»26. Se piensa que este tipo de respuesta se debe a razones farmacodinámicas más que a factores farmacocinéticos. En este sentido, hay datos que apoyan que el uso de buprenorfina mediante comprimidos de absorción sublingual (por sí sola) no induce depresión respiratoria que requiera intervención, incluso aunque se tome en dosis 6 veces superiores a las empleadas habitualmente en el paciente17.
La mayoría de los casos de muerte atribuible a depresión respiratoria por buprenorfina se han comunicado en personas con administración de dosis elevadas de este fármaco por vía intravenosa en combinación con psicofármacos (benzodiacepinas generalmente). No obstante, también existe un riesgo potencial de depresión respiratoria si se administra buprenorfina por vía sublingual junto a la toma de benzodiacepinas, aunque se apunta a que este riesgo sería algo menor que la combinación de metadona-benzodiacepinas.
En caso de sospecha de depresión respiratoria por sobredosis de buprenorfina, la utilidad de la administración de naloxona es limitada, ya que la duración del efecto de la buprenorfina es muy superior a la del antagonista. Por ello, se recomienda una estrecha vigilancia clínica por si fuera necesario el empleo de ventilación mecánica hasta la recuperación de la estabilidad.
Efectos perinatalesLos datos disponibles señalan que la buprenorfina no produce efectos nocivos sobre la gestante, el feto o el neonato (a excepción, en este último caso, de un síndrome de abstinencia de menor intensidad que los descritos con los agonistas opiodes)51. No obstante, el número limitado de estudios y el tipo de diseño empleado en ellos no avalan el uso indiscriminado de la buprenorfina en las gestantes. El número de estudios realizados sobre el preparado de buprenorfina/naloxona es aún menor, por lo que no se recomienda en las gestantes. En este caso, se sigue recomendando el tratamiento con metadona52,53.
En la autorización del producto por parte de la agencia europea EMEA, se señala que la administración de buprenorfina-naloxona en altas dosis al final del embarazo puede producir depresión respiratoria en el recién nacido, y que su administración continuada durante el tercer trimestre del embarazo puede provocar síndrome de abstinencia en el recién nacido.
Efectos cardíacosA pesar de que se han realizado estudios de evaluación de la función cardíaca en pacientes tratados con buprenorfina, hasta el momento no se han constatado evidencias de toxicidad significativa a este nivel54.
Efectos hepáticosEn algunos pacientes se ha observado un incremento leve de los niveles de enzimas hepáticas (TGO, TGP), aunque muchas de estas personas ya tenían niveles altos previos al tratamiento. Se han descrito algunos casos de hepatitis citolítica, sobre todo en personas que se autoadministraban buprenorfina por vía intravenosa55. En cualquier caso, se desaconseja el uso de buprenorfina en pacientes con insuficiencia hepática severa.
Efectos cognitivos y psicomotoresLos datos disponibles hasta la fecha no revelan alteraciones en el funcionamiento cognitivo ni psicomotor en las personas que toman este fármaco17.
Interacciones farmacológicasCon fármacos metabolizados por el citocromo P450 3A4La buprenorfina es metabolizada por el sistema enzimático P450 3A4, por lo que puede aparecer una interacción farmacocinética clínicamente relevante si se administra simultáneamente con otro fármaco que utilice este mismo sistema3. Esto da lugar a un aumento o a una disminución de los niveles plasmáticos de buprenorfina, en función de que el otro fármaco tenga un efecto inhibidor o inductor sobre estas enzimas. En la tabla 1 pueden observarse algunos de estos fármacos y la interacción resultante.
Tabla 1. Principales interacciones farmacológicas de la buprenorfina mediadas por el citocromo P450 3A4.
Con benzodiacepinas y otros psicofármacosYa se ha comentado el riesgo potencial que supone la administración concomitante de buprenorfina y benzodiacepinas, aunque es algo inferior que la combinación de metadona y benzodiacepinas56. A pesar de que la buprenorfina tiene un débil efecto inhibidor sobre el sistema P450 3A4, parece que la potencial depresión respiratoria está mediada por un efecto farmacodinámico más que farmacocinético.
Con agonistas opioidesLos pacientes en tratamiento con metadona que presentan un dolor agudo intenso de cualquier etiología pueden ser tratados con eficacia analgésica mediante el empleo de otro agonista completo de vida media corta. Sin embargo, dadas las características de agonista parcial de la buprenorfina, si un paciente en tratamiento continuado con este fármaco requiriese analgesia mediante un agonista opiáceo durante un tiempo prolongado, habitualmente se prefiere transferir previamente al paciente desde el tratamiento con buprenorfina al de metadona57.
Con antagonistas opioidesLa naltrexona es un fármaco útil en el tratamiento de la dependencia del alcohol, y un porcentaje elevado de pacientes con dependencia de opiáceos la presentan concomitantemente. Sin embargo, un paciente en tratamiento con buprenorfina no debería recibir tratamiento con naltrexona, ya que ésta puede inducir un síndrome de abstinencia.
Indicaciones del programa de tratamiento con buprenorfina-naloxona: aproximación al perfil de candidatosEn los apartados anteriores hemos analizado cómo el perfil farmacológico de la buprenorfina determina su espectro de acción, y se han expuesto las evidencias sobre su eficacia. Debe quedar claro que aún no se ha establecido con rigurosidad cuál es el perfil de pacientes que mejor responde al tratamiento con buprenorfina, en relación al tratamiento con metadona. Aún así, tanto los datos disponibles como la experiencia clínica comunicada por distintos autores permite esbozar algunas características del perfil de pacientes a los que, en principio, la buprenorfina podría reportar alguna utilidad. Entre estas indicaciones estarían:
En este apartado vamos a dar algunas orientaciones sobre los aspectos más concretos del manejo de este fármaco para el tratamiento de la dependencia de opiáceos. Para ello hemos tratado de realizar una síntesis de las recomendaciones ofrecidas por las principales guías publicadas57,58. Hemos dividido la exposición en tres partes, que constituyen tres pasos lógicos en este proceso de intervención, a saber; inducción al tratamiento con buprenorfina, mantenimiento y retirada.
Una vez establecida la indicación del tratamiento con buprenorfina, debe informarse al paciente de las características del mismo, de sus efectos adversos, de la duración, etc. Es necesario destacar la importancia de esta fase de información, ya que es un elemento clave que puede determinar el éxito o el fracaso de todo el programa59.
Inducción al tratamiento con buprenorfinaLa pauta de tratamiento con buprenorfina podrá variar en función de la vida media del opiáceo que el paciente venía tomando previamente (heroína o metadona).
Inducción de buprenorfina desde heroína
Si el paciente viene consumiendo heroína, y dada la vida media de esta sustancia, debe esperarse a que trascurra un mínimo de 6 horas entre la última dosis de heroína y la administración del primer comprimido de buprenorfina.
La primera dosis de buprenorfina dependerá de varios aspectos57:
Grado de neuroadaptación a opiáceos. Los pacientes con un bajo grado de neuroadaptación (tolerancia) deben iniciar el tratamiento con dosis de 2 ó 4 mg el primer día. Por el contrario, si se estima que el grado de neuroadaptación es alto, se iniciará con 6 u 8 mg. La valoración del grado de neuroadpatación es subjetiva, y se basa en la evaluación de la intensidad y la frecuencia del consumo de heroína.
Intensidad de la sintomatología de abstinencia en el momento de administrar la primera dosis de buprenorfina. Evidentemente, cuanto mayor es la intensidad de la sintomatología de abstinencia, mayor será la dosis de buprenorfina administrada. De todos modos, la mayoría de los autores suelen aconsejar que la dosis del primer día debe estar entre 2 y 8 mg, y no sobrepasar esta última dosis. Si el paciente no presenta síntomas de abstinencia en el momento de la administración de la primera dosis de buprenorfina, debe retrasarse algo la toma (hasta el momento en que comience a experimentar algún síntoma de abstinencia).
Consumo simultáneo de otras sustancias de abuso. En este caso, la primera dosis debe ser inferior, y debe valorarse más estrechamente al paciente. Si éste consume heroína entre la primera y la segunda dosis de buprenorfina (habitualmente entre el primer y el segundo día de tratamiento), debe asegurarse que el tiempo transcurrido entre la última dosis de heroína y la primera de buprenorfina sea al menos de 6 horas. Si el paciente continúa consumiendo heroína habría que replantear la indicación de buprenorfina, o bien su inducción en un entorno controlado como una unidad de hospitalización o una comunidad terapéutica.
Inducción del tratamiento con buprenorfina desde metadona
Como ya se ha comentado, la administración de buprenorfina podría desencadenar un síndrome de abstinencia en un paciente que viene tomando previamente metadona, en función de las dosis de ambos opiáceos. Ello es debido a que las moléculas de buprenorfina, con una alta afinidad por el receptor μ, desplazarían a las moléculas de metadona. Por lo general, si un paciente viene tomando una dosis de metadona de 30 mg/día, o menos, no suelen observarse síntomas de abstinencia inducidos al tomar las primeras dosis de buprenorfina.
Como norma general, antes de iniciar la inducción con buprenorfina, debe disminuirse, en lo posible, la dosis de metadona. La pauta de buprenorfina variará en función de la dosis previa de metadona que venía tomando el paciente.
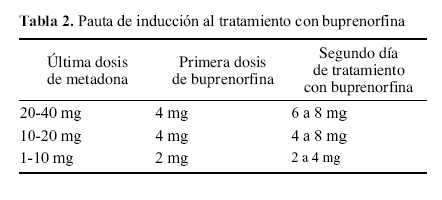
Si el paciente viene tomando una dosis de metadona igual o inferior a 40 mg/día. Suele aconsejarse mantenerle durante una semana con 40 mg/día de metadona, antes de iniciar el tratamiento con buprenorfina (algunos autores aconsejan partir de un máximo de 30 mg/día de metadona). Las dosis de buprenorfina aconsejadas para cada dosis de metadona se recogen en la tabla 2.
Tabla 2. Pauta de inducción al tratamiento con buprenorfina
Si el paciente viene tomando una dosis de meta-dona entre 40 y 60 mg/día. Ya hemos comentado que la dosis ideal de metadona previa a la inducción con buprenorfina debe ser de 30 o 40 mg/día. No obstante, algunos pacientes que toman entre 40 y 60 mg/día no son capaces de reducir más sus dosis de metadona sin que, con ello, experimenten síntomas de abstinencia. Para estos casos se propone una pauta de tratamiento que puede esquematizarse como sigue57:
Al igual que en el tratamiento con metadona, las primeras dosis de buprenorfina tienen como objetivo aliviar la sintomatología de abstinencia, debiendo ser reajustadas sucesivamente para alcanzar todos los efectos esperables de una dosis eficaz (reducción del craving, alcanzar la tolerancia cruzada o «bloqueo» y reducción del consumo continuado de heroína). Para ello, debe re-evaluarse periódicamente al paciente para observar:
Sabemos que la presión asistencial nos obliga a optimizar el número de sesiones de revisión por paciente. No obstante, a continuación se expone la pauta de revisión propuesta por algunos autores:
Ajuste de las dosis de mantenimiento
Al igual que en el tratamiento con metadona, la dosificación de buprenorfina ha de ser un proceso individualizado, no existiendo, en términos absolutos, dosis «altas» o «bajas», sino dosis «adecuadas»60. No obstante, desde una perspectiva poblacional, se ha observado que dosis de 12 a 24 mg/día de buprenorfina son eficaces en términos de reducción del consumo de heroína y aumento de la retención en tratamiento. Sin embargo, muchos pacientes pueden alcanzar estos mismos objetivos con dosis de 8 a 12 mg/día.
No hay evidencia de eficacia adicional con dosis superiores a 24 mg/día. La dosis máxima recomendada es de 32 mg/día. No obstante, y como se comentó en un apartado anterior, ésta es la dosis con la que se alcanza el efecto techo, apareciendo síntomas propios de su actividad agonista-parcial antagonista. Es preciso decir que en la autorización del producto por parte de la agencia europea EMEA se señala que la dosis diaria máxima es de 24 mg.
El estado estacionario de la buprenorfina se alcanza antes que el de metadona, de modo que los máximos efectos esperados para una determinada dosis pueden observarse a los 2-3 días de su toma sucesiva, pudiéndose realizar entonces nuevos ajustes. La forma de la curva dosis-respuesta de buprenorfina indica que pequeños incrementos tienen mayor impacto en dosis bajas, mientras que a dosis altas se requieren mayores incrementos para alcanzar efectos similares. Así, si la dosis previa de buprenorfina es inferior a 16 mg/día, los incrementos deben ser de 2 a 4 mg, mientras que si las dosis previas son superiores a 16 mg/día, los incrementos deben ser de 4 a 8 mg.
Dosis para llevar a casa (take-home)
Los criterios para otorgar el «privilegio» de dar dosis para llevar a casa, o pautas de recogida semanal son similares a los tenidos en cuenta en el tratamiento con metadona.
Intervención psicosocial
El tratamiento con buprenorfina se concibe como un programa de tratamiento multidisciplinar (al igual que el de metadona) donde, además de la prescripción, dispensación y evaluación clínica de la respuesta a este fármaco, se requieren distintas intervenciones coordinadas que busquen cubrir las distintas necesidades del paciente.
Paciente no respondedor
A pesar de tener una dosis adecuada, un paciente en tratamiento con buprenorfina, puede presentar consumos aislados de heroína u otras sustancias. Sin embargo, si este consumo es continuado, se producen algunas sobredosis, alteraciones de conducta asociadas al consumo, o bien un deterioro en la salud física o mental atribuible al consumo de drogas debe replantearse el tratamiento. En primer lugar, debe intentarse un mayor apoyo psicosocial, y reajustar la dosis de buprenorfina (incremento de las dosis, retirada temporal de las autorizaciones semanales y supervisión de la toma del fármaco). Si esto no es posible, habrá que plantear la posibilidad de incorporarse (o reincorporarse, en su caso), al programa de tratamiento con metadona. De forma simultánea, o como alternativa, puede plantearse el tratamiento en una comunidad terapéutica o en una unidad de toxicomanías en el ámbito hospitalario.
Fase de «retirada» del tratamiento con buprenorfinaAl igual que en los programas de metadona, aún hay pocas evidencias sobre cuánto tiempo debe durar el tratamiento con buprenorfina. Los datos de los que disponemos y la lógica de la experiencia clínica nos indican que el tratamiento con buprenorfina debe durar tanto tiempo como sea necesario y siga siendo eficaz para el paciente concreto (salvo en las modalidades de tratamientos de «desintoxicación» de heroína). Se piensa que largos períodos de tratamiento (por ejemplo, más de un año) serían más eficaces que tratamientos cortos (una mayor duración aumentaría la probabilidad de alcanzar los objetivos de mejorar la calidad de vida del paciente)61.
La retirada debe ser un proceso pactado con el paciente y debe contar con el adecuado apoyo médico y psicosocial. El procedimiento habitual es la reducción gradual de las dosis, evaluando cada modificación por si fuera necesario ralentizar o detener el proceso (por ejemplo, aparición de síntomas de abstinencia o aumento en la frecuencia del consumo de heroína). Aunque por las características farmacológicas de la buprenorfina, la sintomatología de abstinencia es más leve que la de metadona y permite reducciones más rápidas. En algunos pacientes puede ser necesaria la administración de algún fármaco no opiáceo que alivie la sintomatología (por ejemplo, antiinflamatorios no esteroideos [AINE], clonidina, antieméticos, benzodiacepinas, etc.).
En la tabla 3 se proponen las tasas de reducción, en función de las dosis previas del paciente.
Tabla 3. Pauta de reducción del tratamiento con buprenorfina
Una eventualidad posible es la retirada del tratamiento con buprenorfina antes de su finalización por reducción paulatina y alta terapéutica. Esto puede deberse a una intolerancia de los efectos de la buprenorfina por parte del paciente, a una respuesta inadecuada a la misma, a un alta o traslado del paciente a un lugar donde la buprenorfina no esté aún disponible, o bien a complicaciones por el uso de antagonistas o agonistas57. Es este caso, la opción habitual es transferir al paciente a tratamiento con metadona. Este proceso es menos complicado que a la inversa. Como norma general, el tratamiento con metadona puede iniciarse a las 24 horas después de la última dosis de buprenorfina, con una dosis inicial máxima de 40 mg. En caso de que el paciente viniese tomando una dosis de buprenorfina de 4 mg o menos, será suficiente comenzar con 20 mg de metadona. A partir de este momento, se ajustarán las dosis de metadona en función de los síntomas y la evolución clínica del paciente. Tan sólo debe tenerse en consideración que las dosis de meta-dona no deben incrementarse con rapidez, ya que al principio aún puede persistir el bloqueo opioide de la buprenorfina, restando eficacia a la metadona.
Aspectos psicosociales de los programas de tratamiento con buprenorfina-naloxonaEl tratamiento farmacológico con buprenorfina-na-loxona para pacientes con dependencia de opiáceos debe estructurarse en el contexto de un programa multidisciplinar de intervención psicosocial56,62. Se ha constado que este tipo de intervención mejora la efectividad del tratamiento con buprenorfina al reducir el consumo de heroína y mejorar la adherencia al programa63. También se ha puesto de manifiesto una disminución del riesgo de recaída en el consumo, y una disminución del craving de heroína64. En principio, el modelo de intervención seguido en estos trabajos no dista del utilizado en los programas de tratamiento con metadona.
Aún no hay evidencias sobre si la intervención psicoterapéutica en pacientes en tratamiento con buprenorfina ha de ser específica o no. Parece razonable establecer diferentes tipos de intervención en función del perfil de los pacientes, sus objetivos, sus necesidades y sus preferencias y la orientación del programa. Así, si el paciente ha iniciado un tratamiento con buprenorfina tras ser transferido desde un programa de metadona, con el objetivo de abandonar el tratamiento con opiáceos, la intervención irá más orientada a la abstinencia. Por el contrario, si un paciente inicia un tratamiento con buprenorfina con vistas al «mantenimiento», el modelo de intervención será más similar al empleado en los programas de metadona. Al igual que en éstos, se ha demostrado una relación entre la efectividad del programa de tratamiento con buprenorfina y el período de estancia en el mismo61.
ConclusionesLa buprenorfina-naloxona es una alternativa farmacológica con un buen perfil de eficacia y seguridad para el tratamiento de la dependencia de opiáceos. Aunque la metadona va a seguir siendo, por el momento, el agonista de elección para la mayoría de los pacientes con dependencia de opiáceos, la buprenorfina, por sus características farmacocinéticas y farmacodinámicas, va a ser un fármaco muy útil para un determinado perfil de pacientes. Es importante no olvidar que el abordaje del paciente drogodependiente ha de ser integral y que, además de la buprenorfina, deben organizarse los apoyos psicosociales necesarios, constituyendo un verdadero programa asistencial. Como ya hemos comentado, la buprenorfina va a venir a cubrir ese espacio existente entre los programas de metadona y los denominados «programas libres de drogas».
Los autores declaran que no existe conflicto de interés.
Correspondencia:
F. GONZÁLEZ-SAIZFundación Andaluza para la Atención a las Drogodependencias e Incorporación Social (FADAIS). Avda. Hytasa, edificio Toledo II, Plt. 3.ª Ofic. n.º 1 41006 Sevilla. España. Correo electrónico: pacogonzalez@comcadiz.com
Recibido: 17-12-2007 Aceptado para su publicación: 14-01-2008