Introducción
La buprenorfina está comercializada en España desde hace ya bastantes años1; en concreto, estaba y está disponible como comprimidos sublinguales de 0,2 mg, e inyectables de 0,3 mg, con los nombres comerciales de Buprex® y Perfin®. Más recientemente se ha comercializado en forma de parches, con el nombre de Transtec®. La indicación reconocida para estas presentaciones farmacéuticas es la del tratamiento del dolor; precisa de receta médica y es reembolsado o financiado por el Sistema Nacional de Salud y/o las comunidades autónomas (CCAA)1-3.
Desde 2000 está autorizada una nueva indicación y presentación de buprenorfina, Subutex®. Buprenorfina fue aprobada el 12 de abril de 2000 por la Agencia Española del Medicamento para el «tratamiento de sustitución a la dependencia mayor de opiáceos en el marco de un amplio tratamiento médico, social y psicológico» (apartado 4.1 del Resumen de las Características del Producto, versión de abril de 2.000, actualización de octubre 2002)4. Las formulaciones son de 2 y 8 mg en comprimidos para uso sublingual. El precio de venta Laboratorio, es de 3.90 euros para la formulación de 2 mg/7 comprimidos y de 15,59 euros para la de 8 mg/7 comprimidos4.
De 2002 a 2004: la autorización de comercialización como preparado de uso hospitalario y estupefaciente a preparado con receta médica de psicotropo
A diferencia de las formulaciones y preparados comerciales de buprenorfina anteriormente disponibles para el tratamiento del dolor, en las condiciones de dispensación como preparado para el tratamiento de la dependencia a opiáceos está clasificado como de uso hospitalario y con receta de estupefacientes (véase información terapéutica del Sistema Nacional de Salud; 2001;25:27-30). Además, se incluía como medicamento no reembolsable o no financiado por el Sistema Nacional de Salud y/o de las CCAA2,3,5.
Quizás, estas decisiones2 se tomaron en parte en función de la normativa vigente sobre los tratamientos de deshabituación con metadona y otros opiáceos. Así, la Orden del 31 de octubre de 1985 (BOE n.o 269 de 9 de noviembre) y el Real Decreto 75/90, por el que se regulan los tratamientos con opiáceos de personas dependientes de éstos (BOE n.o 20 de 23 de enero), incluye en la lista de principios activos sometidos a dicha norma a la buprenorfina. Posteriores modificaciones, como el Real Decreto 5/1996 de 15 de enero (BOE n.o 44 de 20 de febrero) que modifica el articulo 3 y 9 del Real Decreto 75/90, han ido en el mismo sentido.
En dichas normas (Reales Decretos 75/90 y 5/96), por las que se regulan estos tratamientos, se dispone en el artículo 3 los requisitos referentes a la prescripción, elaboración, conservación, dispensación, administración y formulación, que en todo caso deben realizarse exclusivamente a través de los centros acreditados por las propias CCAA (artículo 2). Es obvio que dichos aspectos pueden ser adecuados para el caso de la metadona, pero no para otros principios activos, como es el caso de la buprenorfina.
La situación creada era tan confusa y anómala que, tal como se ha señalado4, «con fecha 6 de abril de 2003, la Agencia Española del Medicamento emite una circular informativa (circular n.o 06/2003 de 6 de abril) sobre las condiciones de distribución de especialidades farmacéuticas conteniendo estupefacientes o psicotrópicos autorizadas para el tratamiento de la dependencia a opiáceos. En ella se aclara que durante los últimos años se han autorizado especialidades farmacéuticas para este tipo de tratamientos restringiendo su uso con la calificación de uso hospitalario, por no existir una denominación que se adapte específicamente a las condiciones especiales de dispensación a las que están sujetas estas especialidades. Con esta circular se pretende aclarar que dicha calificación de uso hospitalario sólo pretende restringir la prescripción y dispensación de estas especialidades farmacéuticas para el tratamiento de deshabituación de los pacientes afectados de un trastorno por dependencia a opiáceos, exclusivamente a los centros y oficinas de farmacia acreditados por las autoridades sanitarias de las CCAA»4.
Afortunadamente, en la actualidad, se ha rectificado la autorización de comercialización del Subutex®, de forma que en la nueva autorización consta como requisitos de dispensación: «con receta médica de psicotropo». Es decir, se eliminó la condición de uso hospitalario y se sustituyó la condición de estupefaciente por la de psicotropo.
En mi opinión, dichas modificaciones por parte de la Agencia Española del Medicamento me parecen correctas y acordes con el uso clínico de este preparado. Los lectores pueden analizar mis opiniones y razones señaladas a este respecto en una editorial previa2.
¿Qué pasa con la financiación de la buprenoprfina-Subutex® por parte del Sistema Nacional de Salud/comunidades autónomas?
Mi opinión sobre la financiación por parte del Sistema Nacional de Salud/CCAA es clara: debería ser un medicamento financiado por el mismo. Esta opinión no es gratuita, se basa en su perfil de eficacia y seguridad. Desde luego, lo que no me parece correcto es que los tratamientos para determinadas dependencias, caso por ejemplo del tabaco, o dependencia a opiáceos (LAAM y ahora buprenorfina) no sean financiados por el sistema sanitario público, cosa que no ocurre con el tratamiento de otras patologías.
Como he señalado con anterioridad2 «resulta altamente sorprendente y paradójico que los pacientes con dependencia a opiáceos tengan financiada con cargo al Sistema Nacional de Salud o de las CCAA toda la medicación que necesitan (antirretrovirales, de la hepatitis C, antituberculosos, etc.) y que la nueva presentación de buprenorfina, que sirve para tratar su enfermedad de base, y que diversos estudios la han mostrado como altamente eficaz y que reduce la mortalidad asociada6,7, queda sin incluir dentro del presupuesto farmacéutico y recaiga en los planes o programas de drogodependencias de las distintas CCAA. Es, sin duda alguna, un contrasentido que creemos debe corregirse. Además, gran parte de los dependientes de opiáceos están en paro, con lo cual difícilmente pueden hacer frente al coste de este tratamiento farmacológico, por lo demás mucho menos caro que el tratamiento antirretroviral, de la hepatitis C y de la tuberculosis».
En la actualidad, está pendiente de conocerse si la Dirección General de Farmacia y Productos Sanitarios incluye o no dentro de la prestación farmacéutica de la Seguridad Social al Subutex®. La Dirección General de Farmacia y Productos Sanitarios indicó, en octubre de 2003, que inició el procedimiento para decidir si Subutex® se incluía o no dentro de la prestación farmacéutica de la Seguridad Social. En enero de 2005 ha indicado que este preparado irá desprovisto de cupón de precinto de asistencia sanitaria a la Seguridad Social. Es decir no es financiado por el Sistema Nacional de Salud.
Es obvio que otra posibilidad de cubrir el coste del tratamiento con buprenorfina de los pacientes con dependencia a opiáceos, es que se haga cargo de ello los planes regionales o autonómicos sobre drogas, en función de la legislación vigente ya mencionada con anterioridad (Reales Decretos 75/90 y 5/96). No obstante, no creo, en mi opinión, que sea ésta una opción adecuada: dicha norma está bien para la metadona. En el caso de la buprenorfina no tiene sentido que los paciente vayan al centro de atención de drogodependientes a recibir la dosis e ingerirla delante del personal sanitario. Como pasa con cualquier medicación, el paciente debe ir a la farmacia a retirar la medicación prescrita. Una alternativa podría ser entregar el envase con dicha medicación en los centros de atención a drogodependientes; es decir, que los planes regionales-autonómicos de drogas adquirieran la medicación y fuesen los profesionales de los centros los que la distribuyeran a los pacientes.
Esta opción iría en contra de la manera de proceder del resto de países, donde está comercializada la buprenorfina-Subutex®. Por poner 2 ejemplos, la experiencia en Francia8 y Estados Unidos9, con una prescripción por cualquier médico (Francia) o que ha recibido un cierto grado de capacitación (Estados Unidos), y una dispensación a través de las oficinas de farmacia, ha demostrado ser el medio más adecuado.
Simplemente, la opción, la única opción en mi opinión, es que sea financiado por el Sistema Nacional de Salud (o por las CCAA).
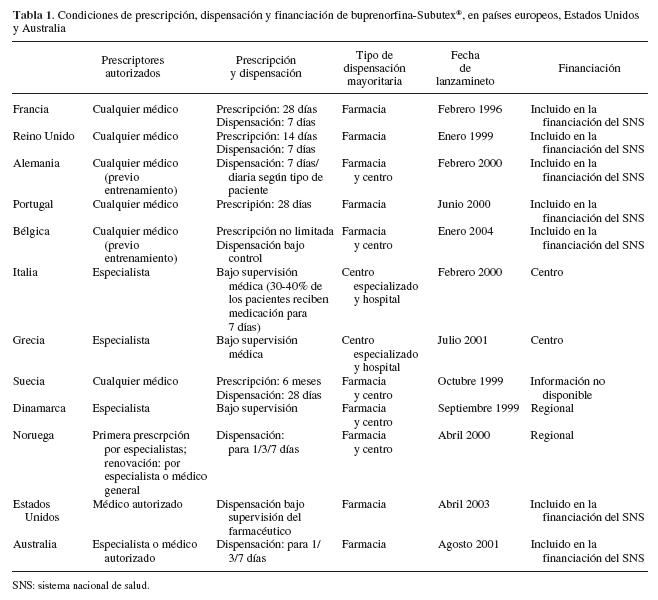
En la tabla 1 se presenta el sistema de registro, la prescripción-dispensación y el modo de financiación de la buprenorfina-Subutex® en varios países de la Unión Europea y Estados Unidos. En Canadá acaba de ser recientemente aprobada su comercialización.
Resumen de las características del producto y ficha técnica de la buprenorfina: imposibilidad de encontrarlas
El resumen de la características del producto (RCP) y la ficha técnica, entre otros, son documentos clave para el profesional sanitario. Son documentos en los que figuran las condiciones de registro del producto de acuerdo a la normativa europea (CD 2001/83/EC)10 y es una información contrastada y vinculante al profesional que lo prescribe y dispensa (p. ej., condiciones de uso, indicaciones, dosis, etc.).
En los últimos años, en la web del Ministerio de Sanidad y Consumo era posible acceder al RCP de los medicamentos registrados. En muchos casos, en la web de los laboratorios se incluyen estos documentos en relación con sus productos.
En la actualidad cualquier profesional sanitario de España que quiera acceder a dicha información se encontrará con que no está disponible. Es decir, el RCP de la buprenorfina-Subutex® está «desaparecido». Desde aquí quiero señalar que es imprescindible que dicha información este disponible.
Igualmente, si un profesional sanitario consulta el Vademécum11 o el Catálogo de Especialidades Farmacéuticas12 se encontrará con que no aparece ninguna información acerca de la buprenorfina-Subutex®.
Buprenorfina-Subutex®: un fármaco registrado pero no comercializado
Dadas todas las dificultades hasta ahora existentes, en la práctica, España es el único país de los desarrollados («España es diferente», el famoso slogan de turismo de hace años) que tiene autorización de comercialización de la buprenorfina-Subutex® pero que no está comercializada; es decir, los médicos no la podemos prescribir. Mientras tanto, algunos pacientes que podrían beneficiarse de dicho tratamiento, no lo pueden recibir.
Es preciso que los organismos competentes, Ministerio de Sanidad y Consumo, Dirección General de Farmacia y Productos Sanitarios, adopten una solución que, a mi entender, sólo pasa por incluirlo dentro de la prestación farmacéutica de la Seguridad Social.
Como he señalado con anterioridad2, «debemos reconocer que las sociedades científicas que trabajan en este campo, los profesionales que intervienen en drogodependencias, los investigadores que trabajamos en este campo, los comisionados o planes autonómicos en drogodependencias, y el Plan Nacional sobre Drogas, han fallado en conseguir que la buprenorfina esté disponible para el tratamiento de la dependencia a opiáceos en condiciones adecuadas: financiado por el Sistema Nacional de Salud y disponible para uso ambulatorio».
Buprenorfina + naloxona
Es preciso señalar además, que en Estados Unidos13 y otros países, se ha registrado, o se va a registrar próximamente, una formulación de buprenorfina + naloxona (Subuxone®) para uso por vía sublingual, con lo cual se evita el potencial abuso de este preparado si se inyecta, ya que la naloxona bloquearía el efecto agonista (parcial) de la buprenorfina3 y se reducirían los casos de intoxicación/sobredosis por esta vía.
Es decir, además, proponemos a las autoridades con responsabilidad en el tema que promuevan el registro de la formulación de buprenorfina + naloxona en comprimidos sublinguales que se utilizarían en el tratamiento de mantenimiento.
Conclusiones: buprenorfina-Subutex® y las condiciones de prescripción y financiación
Buprenorfina-Subutex® fue aprobada en 2000 por la Agencia Española del Medicamento para el «tratamiento de sustitución a la dependencia mayor de opiáceos en el marco de un amplio tratamiento médico, social y psicológico», si bien en las condiciones de dispensación estaba clasificado como de uso hospitalario y con receta de estupefacientes. Además, se incluía como medicamento no reembolsable o no financiado por el Sistema Nacional de Salud y/o de las CCAA.
Afortunadamente, estas condiciones (uso hospitalario y receta de estupefacientes) se han modificado recientemente (octubre de 2003), de forma que en la
nueva autorización consta como requisitos de dispensación: «con receta médica de psicotropo». Es decir, se eliminó la condición de uso hospitalario y se sustituyó la condición de estupefaciente por la de psicotropo.
En la actualidad está pendiente (desde 2003) de conocerse si la Dirección General de Farmacia y Productos Sanitarios (Ministerio de Sanidad y Consumo) incluye o no dentro de la prestación farmacéutica de la Seguridad Social al Subutex®. Creemos que debería ser un medicamento financiado por el mismo. Esta opinión no es gratuita: se basa en su perfil de eficacia y seguridad. En enero de 2005 se ha indicado que no será financiado por el Sistema Nacional de Salud.
Urgimos a que las autoridades sanitarias promuevan el registro y la comercialización del preparado bufrenorfina-naloxona (Subuxone®) con lo cual se evita el potencial abuso de este preparado si se inyecta, se disuadiría de su uso por esta vía y se harían más infrecuentes las situaciones de intoxicación-sobredosis (sólo o con tranquilizantes).
Finalmente, creemos que la documentación técnica del preparado (RCP, etc.) debe estar accesible a los profesionales sanitarios.
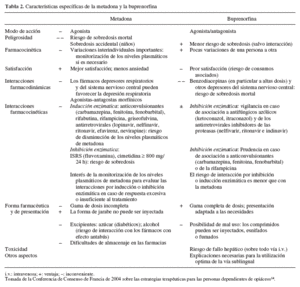
En la tabla 2 se presenta una comparación de metadona y buprenorfina sobre distintos aspectos. Esta tabla está tomada de la Conferencia de Consenso de Francia de 2004 sobre las estrategias terapéuticas para las personas dependientes de opiáceos14.
Conflicto de intereses
F. Javier Álvarez ha impartido conferencias sobre buprenorfina en el tratamiento del dolor y de la dependencia a opiáceos que, en algunos casos, han sido organizadas y/o retribuidas por la industria farmacéutica.