Artículo Original
Información del artículo
Historia del artículo:
Recibido el 25 de octubre de 2023
Aceptado el 14 de diciembre de 2023
On-line el 26 de enero de 2024
Palabras clave:
Síndrome de Down
Hipotiroidismo subclínico
Niños
Adolescentes
Tratamiento
*Autor para correspondencia
Correo electrónico:
aloeq@hotmail.com
(A.L. Quiralte Cairols).
Keywords:
Down syndrome
Subclinical hypothyroidism
Children
Teenagers
Treatment
Aloe Loida Quiralte Cairolsa,*, Amparo Quilesb, José Villarroyac, Joan Rodad, José D. Bermúdeze, Rafael Fernández-Delgadof
aSAMU de Xàtiva (Valencia). bCentro de Salud de Benifairó de les Valls (Valencia). cCentro de Salud de Plaza de Segovia (Valencia). dCentro de Salud de Sueca (Valencia). eDepartamento de Estadística. Universidad de Valencia. fDepartamento de Pediatría. Universidad de Valencia.
Resumen
Introducción. El hipotiroidismo subclínico es frecuente en el síndrome de Down; sin embargo, no hay consenso en determinar cuándo iniciar el tratamiento hormonal sustitutivo en dicho colectivo.
Objetivo. El objetivo principal es determinar la variabilidad de la normalidad tiroidea en niños y adolescentes con síndrome de Down, con la finalidad de comentar la pertinencia de iniciar o no tratamientos tempranos en dichas personas.
Metodología. Este estudio observacional, retrospectivo, prospectivo y descriptivo, hace un seguimiento a pacientes que presentan hipotiroidismo subclínico. Se incluyeron todas las personas con síndrome de Down menores de 18 años que fueron atendidas a través del programa de salud específico y que tuvieran realizadas un mínimo de dos determinaciones sanguíneas.
Resultados. De una muestra inicial de 552 pacientes, se escogieron 331 que presentaban hipotiroidismo subclínico y más de una determinación analítica. Observamos que el 8,46 % desarrolló hipotiroidismo verdadero y el 91,54 % se mantuvo en hipotiroidismo subclínico.
Conclusiones. La variabilidad de la función tiroidea en las personas con síndrome de Down es amplia. En nuestra muestra, la función tiroidea se normalizó en el 32,7 % en los pacientes con hipotiroidismo subclínico sin tratamiento; en cuanto al resto, la gran mayoría se mantuvo en hipotiroidismo subclínico con cifras normales de T4L. Por tanto, es prudente afirmar que el inicio de tratamiento tiroideo sustitutivo debe ser individualizado y realizar en la mayoría de los casos varios controles previos a la toma de decisiones para evaluar la tendencia de la función tiroidea.
© 2023 Sociedad Española de Médicos Generales y de Familia.
Publicado por Ergon Creación, S.A.
Subclinical hypothyroidism and Down’s syndrome: need for an expectant attitude in children and adolescents
Abstract
Introduction. Subclinical hypothyroidism is frequent in Down syndrome; yet, there is a lack of consensus about indications for hormone replacement therapy use.
Objective. The main goal of this study is to determine the variability of thyroid function in Down syndrome children and adolescents over time, and thus evaluate the need for starting early treatment.
Methods. An observational, retrospective and prospective, descriptive and long-term study of patients with subclinical hypothyroidism including patients under 18 years old attending a specific health program with at least two available blood tests.
Results. From an initial sample of 552 patients, 331 presented subclinical hypothyroidism and more than one analytic result and were included. Only 8.46% developed true hypothyroidism, while 91.54% remained in subclinical hypothyroidism.
Conclusions. Thyroid function shows wide variability over time in Down syndrome. In our sample, hormonal levels normalized in 32.7% of patients with untreated subclinical hypothyroidism, and most of the rest remained in subclinical hypothyroidism, with normal T4 levels. Therefore, the decision to start thyroid substitutive treatment must be individualized, and in most cases several tests are needed to evaluate trends in thyroid function before initiating therapy.
© 2023 Sociedad Española de Médicos Generales y de Familia.
Published by Ergon Creación, S.A.
Introducción
El hipotiroidismo es una enfermedad endocrinológica con una prevalencia en pacientes pediátricos de 1-2 %1,2. En la población con síndrome de Down esta prevalencia se incrementa y predomina el hipotiroidismo subclínico, que llega a ser del 32 %3-7.
El hipotiroidismo subclínico es asintomático. Se define por presentar cifras normales de T4 libre (tiroxina) con TSH (hormona estimulante de la tiroides) por encima del límite superior de la normalidad. Su abordaje, a diferencia de lo que ocurre con el hipotiroidismo verdadero, no está consensuado. No obstante la mayoría de autores recomienda tratarlo a partir de una TSH ≥ 10 µU/ml8, así como ante un título elevado de anticuerpos antitiroideos; se amparan en que en un futuro la mayoría desarrollará hipotiroidismo verdadero9-11. Incluso hay expertos que también aconsejan el tratamiento del hipotiroidismo subclínico ante determinadas situaciones estresantes, como una intervención quirúrgica o una infección, pues pueden desencadenar un hipotiroidismo verdadero o mixedema12. Sin embargo, otros autores consideran que la hipertirotropinemia (definida como una elevación de TSH con niveles normales de T4 y T3, sin clínica acompañante) en el paciente con síndrome de Down no tiene significado clínico y que, siempre que no aparezcan síntomas ni disminuya por debajo de los límites normales la T4 libre, no hace falta instaurar tratamiento sustitutivo13-15.
Los valores de referencia normales de parámetros analíticos tiroideos varían con la edad y el sexo. No obstante, la mayoría de los autores determinan que dicho límite parece encontrarse en 4-5 µU/ml, según el método analítico empleado8,16. Al no existir un consenso acerca del rango que debemos utilizar a la hora de interpretar la normalidad tiroidea en la edad pediátrica, independientemente de la presencia o no de trisomía 21, estimar un intervalo de valores de referencia normales es difícil en muchas ocasiones17,18, sobre todo en el rango de una TSH entre el límite superior de referencia y 9,9 µU/ml8, pues por encima de 10 existe un mayor consenso de iniciar tratamiento.
Objetivo
Este estudio tiene como objetivo principal determinar la variabilidad individual y colectiva de la normalidad tiroidea en niños y adolescentes con síndrome de Down, así como la evolución clínica de los mismos a través de las revisiones del Programa de Salud para personas con Síndrome de Down en Valencia.
Pacientes, material y métodos
Presentamos un estudio observacional retrospectivo y prospectivo, descriptivo y longitudinal, aprobado por el comité ético del Hospital Clínico Universitario de Valencia.
Este estudio incluye a los pacientes que han sido valorados en el Programa de Salud para Personas con Síndrome de Down entre 1993 y 2016, con al menos dos determinaciones sanguíneas de hormonas tiroideas durante este periodo y con una edad inferior o igual a 18 años en el momento de la realización del primer análisis. Todos los pacientes residían en la Comunidad Valenciana, y constituyen una población yodo-suficiente. El mencionado programa se realiza en el Hospital Clínico de Valencia en colaboración con Asindown Valencia (entidad fundada en 1989 por familias que tienen un hijo con síndrome de Down).
Las variables principales de este estudio son los valores de T3, T4 libre y total, TSH, antiperoxidasa tiroidea (antiTPO) y antitiroglobulina (antiTG), la presencia o no de patología tiroidea, su tipo y su tratamiento si lo hubiera (tabla 1).
También se registró la edad en el momento del estudio, el sexo, si presentaban enfermedades autoinmunes (tales como celiaquía o diabetes tipo 1), la presencia de antecedentes familiares de patología tiroidea y si se les había realizado una ecografía de la glándula tiroidea (tabla 2).
Para este trabajo se seleccionó a los que presentaron cifras de TSH y T4 libre compatibles con hipotiroidismo subclínico y se vigiló su evolución.
Los diversos parámetros se recabaron de los formularios de entrevista clínica completados en cada visita por los médicos del Programa de Salud. Las determinaciones hormonales se obtuvieron de los análisis de los pacientes que estaban incluidos en la historia clínica, con independencia del laboratorio en el que se hubiese analizado la muestra.
La base de datos utilizada para el registro de los pacientes fue una tabla de Microsoft Excel, edición 2007; para el tratamiento estadístico se utilizó el programa de análisis estadístico IBM SPSS, versión 24 (Armonk, Nueva York, Estados Unidos).
Cada paciente se realizó la analítica en su centro de salud u hospital de referencia. Aunque todos los laboratorios utilizaron el mismo método de radioinmunoanálisis (concretamente la técnica de ELISA), el intervalo de referencia era ligeramente distinto en cada uno de ellos. Para poder comparar los resultados, se homogeneizaron con ayuda del Departamento de Estadística de la Facultad de Matemáticas de la Universidad de Valencia. Para ello se obtuvo una fórmula matemática que asimilaba al mismo rango cada uno de los valores, en función del intervalo de referencia establecido en cada laboratorio. El procedimiento se explica en el anexo 1.
Tras la homogenización de los valores de las hormonas tiroideas, el intervalo de referencia se estableció en el que fue mayoritario para nuestra muestra:
- T4L: 0,93-1,7 ng/dl
- T3: 0,8-2 nmol/L
- TSH: 0,27-4,2 µU/ml
- Anti TPO: 0-15 U/ml
- Antitiroglobulina: 0-100 U/ml
Teniendo dichos parámetros en cuenta, se definió cada determinación analítica según las siguientes alteraciones:
- Cribado tiroideo negativo o eutiroidismo: TSH 0,27-4,2 µU/ml; T4L 0,93-1,7 ng/dl.
- Cribado tiroideo positivo:
- Hipertiroidismo: TSH < 0,27 µU/ml; T4L > 1,7 ng/dl.
- Hipotiroidismo subclínico: TSH > 4,2 µU/ml; T4L 0,93-1,7 ng/dl.
- Hipotiroidismo verdadero: TSH > 4,2 µU/ml; T4L < 0,93 ng/dl.
Resultados
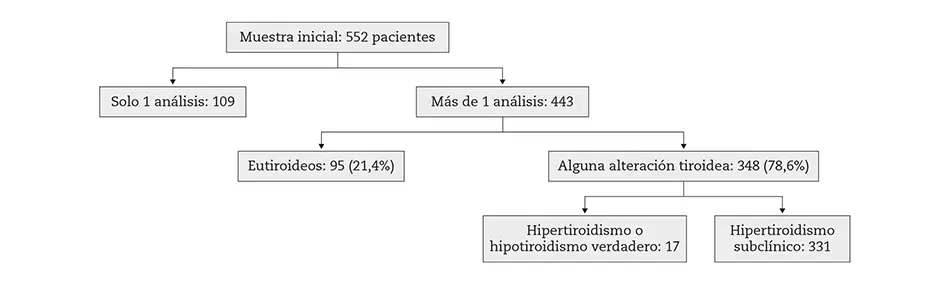
Inicialmente se recogió la información de 552 pacientes, de los cuales se excluyeron 109 por tener solo un análisis durante el periodo del estudio, por lo que no se pudo establecer una evolución de la función tiroidea en los mismos. En los 443 restantes se analizó si tuvieron alguna alteración tiroidea en alguna de las analíticas obtenidas: se encontró, por un lado, que el 21,4 % (95 pacientes) estuvo eutiroideo en todo momento; por otro lado, que el 78,6 % (348 pacientes) presentaron algún disfunción tiroidea (figura 1).
De estos últimos, se descartó a quienes tenían hipertiroidismo o hipotiroidismo verdadero (17 pacientes), de forma que la población diana fue de 331 pacientes con hipotiroidismo subclínico.
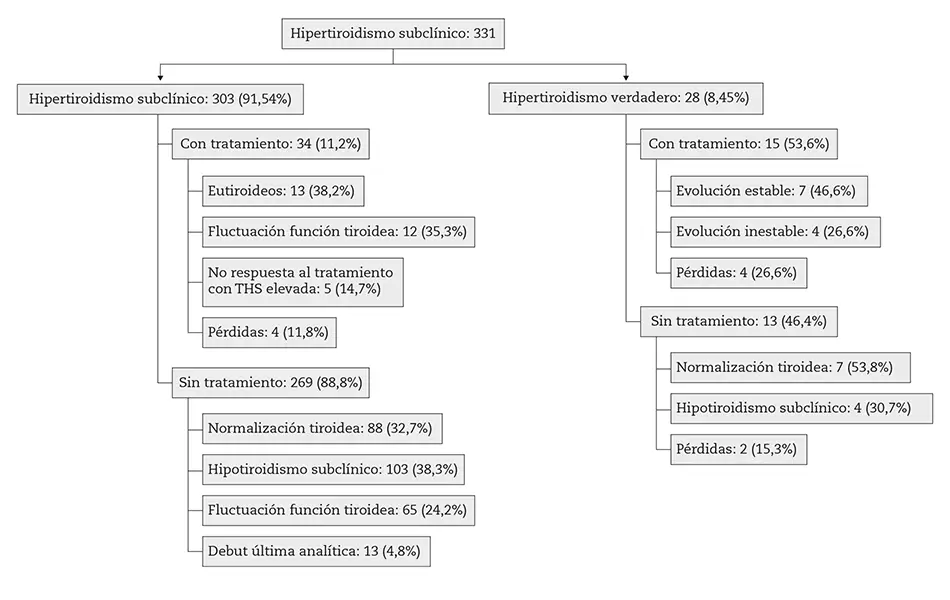
Dentro de nuestra muestra final encontramos que hubo 28 pacientes (8,45 %) que desarrollaron hipotiroidismo verdadero con posterioridad, mientras que los otros 303 (91,54 %) no desarrollaron en ningún momento hipotiroidismo verdadero.
De los primeros, 15 iniciaron tratamiento con levotiroxina y 13 no recibieron tratamiento antes del siguiente control. Entre los primeros encontramos que 7 presentaron una evolución estable; 4 tuvieron una evolución inestable (alternancia de valores de TSH compatibles con hipo e hipertiroidismo) y los 4 restantes se perdieron en el seguimiento. Entre los segundos, en 7 se normalizó la función tiroidea, 4 volvieron a presentar hipotiroidismo subclínico y 2 no siguieron los controles analíticos.
De los pacientes con hipotiroidismo subclínico en la primera analítica, 269 no recibieron tratamiento en ningún momento mientras que 34 sí. Dentro del primer grupo, 88 evolucionaron hacia la normalización de forma espontánea en un tiempo variable, 103 permanecieron en situación de hipotiroidismo subclínico, 65 presentaron una fluctuación de la función tiroidea, con periodos de eutiroidismo y otros de hipotiroidismo subclínico, y en 13 no se pudo saber la evolución, ya que el debut del hipotiroidismo subclínico se objetivó en el último análisis.
De los 34 pacientes con debut de hipotiroidismo subclínico que iniciaron tratamiento con levotiroxina, 13 permanecieron con función tiroidea estable normal, 17 presentaron una respuesta inestable al tratamiento (de forma que 12 de ellos alternaron periodos de hipertiroidismo con otros de hipotiroidismo), mientras que 5 presentaron cifras de TSH elevadas de forma persistente pese al tratamiento; de los pacientes restantes, 3 interrumpieron el seguimiento en el Programa de Salud antes de evaluar la efectividad del tratamiento y 1 abandonó el tratamiento (figura 2).
En la tabla 1 se recogen las medias de las variables de la función tiroidea divididas por subgrupos.
Encontramos un porcentaje mayor de hombres (53,8 %) que de mujeres (46,2 %). La gran mayoría no tenía antecedentes familiares de patología tiroidea, ni se les realizó ninguna ecografía tiroidea, ni presentaban alguna enfermedad inmunitaria (como la celiaquía o la diabetes) (tabla 2).
Figura 1 – Muestra inicial.
Figura 2 – Hipotiroidismo subclínico.
Comentarios
Nuestro objetivo ha sido estudiar la evolución del hipotiroidismo subclínico con el fin de intentar dilucidar la pertinencia de un inicio temprano del tratamiento en pacientes con síndrome de Down, debido a las discrepancias al respecto entre los distintos grupos investigadores.
En el Programa Español de Salud para Personas con Síndrome de Down se recomienda la realización de al menos una determinación anual de hormonas tiroideas. Siguiendo estas indicaciones, se ha estudiado a nuestros pacientes y se han extraído los datos de nuestro estudio.
El primer caso de hipotiroidismo asociado a síndrome de Down fue publicado por Marañón en 1951, referido por Prasher19. A partir de ahí, se comunicaron más de 40 estudios individuales20-22. De 1963 datan los primeros estudios en grupos de personas con síndrome de Down, con el objetivo de establecer la prevalencia de alteraciones tiroideas. De todos los estudios revisados, solo cuatro se han realizado en más de 500 pacientes (Reguera et al, N= 1.105 niños y adolescentes3; McGowan et al, N= 1.329 niños y adolescentes9; Claret et al, N= 1.903 niños y adultos23 y Fort et al, N= 1.130 neonatos24); solo los dos primeros abarcan toda la edad pediátrica de forma exclusiva. Por tanto, el nuestro es uno de los estudios con mayor número de niños y adolescentes estudiados, con el añadido de presentar múltiples valoraciones para cada paciente y un seguimiento medio aproximado de 6 años.
Casi todos los autores coinciden en que la alteración tiroidea más frecuente en el síndrome de Down es el hipotiroidismo primario subclínico, mientras que el hipertiroidismo o enfermedad de Graves es menos frecuente3,25,26. En nuestros pacientes, la alteración tiroidea inicial apareció en la mayoría de las veces (78,56 %) en el primer análisis; el 98,95 % debutó con hipotiroidismo, en la mayoría de los casos subclínico (96,22 %). El 21,44 % restante no desarrolló ninguna alteración durante el periodo de observación.
Por tanto, podemos deducir que es necesario estudiar la función tiroidea de forma evolutiva.
Conclusiones
La prevalencia global de alteraciones tiroideas, permanentes o transitorias, en nuestra muestra fue del 78,56 %. Un número importante de pacientes (28,7 %) se normalizó sin necesidad de tratamiento; algunos mostraron una evolución inestable de la función tiroidea, en la que se alternaban periodos de eutiroidismo con otros de hipotiroidismo subclínico.
La alteración tiroidea más frecuente observada en nuestro estudio fue el hipotiroidismo subclínico, seguido del verdadero y, finalmente, de hipertiroidismo.
La variabilidad de la función tiroidea en las personas con síndrome de Down es tan amplia que se debe mantener una actitud prudente cuando nos encontremos con pacientes con alteraciones tiroideas. Se debe ajustar el seguimiento posterior para poder individualizar la toma de decisiones y administrar tratamiento sustitutivo siempre que sea necesario, pero no obligar a los niños o adolescentes con síndrome de Down a llevar este tratamiento durante largos periodos de tiempo de forma innecesaria.
Agradecimientos
Los autores agradecen a todos los voluntarios del Programa de Salud para Personas con Síndrome de Down y la Fundación Asindown su participación y su continuo compromiso con el proyecto.
El apoyo a la redacción médica fue proporcionado por Fernando Martínez Rodríguez, politólogo especializado en políticas públicas.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- Mayayo E, Labarta JI, Gil MM. Enfermedad tiroidea. An Pediatr Contin. 2006; 4(6): 361-74. https://doi.org/10.1016/S1696-2818(06)73638-1
- Hanley P, Lord K, Bauer A. Thyroid Disorders in Children and Adolescents. JAMA Pediatr. 2016; 170(10): 1008-19. https://doi.org/10.1001/jamapediatrics.2016.0486
- Regueras L, Prieto P, Muñoz-Calvo MT, Pozo J, Arguinzoniz L, Argente J. Alteraciones endocrinológicas en 1.105 niños y adolescentes con SD. Med Clin (Barc) 2011; 136(9): 376-81. https://doi.org/10.1016/j.medcli.2010.06.029
- Kariyawasam D, Carré A, Luton D, Polak M. Down syndrome and nonautoimmune hypothyroidisms in neonates and infants. Horm Res Paediatr. 2015; 83(2): 126-31. https://doi.org/10.1159/000370004
- Aversa T, Lombardo F, Valenzise M, Messina MF, Sferlazzas C, Salzano G, et al. Peculiarities of autoimmune thyroid diseases in children with Turner or Down syndrome: an overview. Ital J Pediatr. 2015; 41: 39. https://doi.org/10.1186/s13052-015-0146-2
- Unachak K, Tanpaiboon P, Pongprot Y, Sittivangkul R, Silvilairat S, Dejkhamron P, et al. Thyroid functions in children with Down’s syndrome. J Med Assoc Thai. 2008; 91(1):56-61. PMID: 18386545.
- Nuñez Silva DS, Cevallos Teneda AC. Actualización del manejo integral del hipotiroidismo subclínico. Ciencia Latina Rev Científica Multidisciplinar. 2022; 6(7): 770-83. https://doi.org/10.37811/cl_rcm.v6i4.2625
- Salermo M, Importa N, Capalbo D. Management of endocrine disease: Subclinical hypothyroidism in children. Eur J Endocrinol. 2020; 183(2): 13-28. https://doi.org/ 10.1530/EJE-20-0051
- McGowan S, Jones J, Brown A, Reynolds L, Leyland K, Charleton P, et al; Scottish Down Syndrome Thyroid Screening Group. Capillary TSH screening programme for Down’s syndrome in Scotland, 1997-2009. Arch Dis Child. 2011; 96(12): 1113-7. https://doi.org/10.1136/archdischild-2011-300124
- Gibson PA, Newton RW, Selby K, Price DA, Leyland K, Addison GM. Longitudinal study of thyroid function in Down’s syndrome in the first two decades. Arch Dis Child. 2005; 90(6): 574-8. https://doi.org/10.1136/adc.2004.049536
- Oliveira AT, Longui CA, Calliari EP, Ferone Ede A, Kawaguti FS, Monte O. Evaluation of the hypothalamic-pituitary-thyroid axis in children with Down syndrome. J Pediatr. 2002; 78(4): 295-300. PMID: 14647760
- James R, James J, Vij AS, Vij KK. Postoperative myxoedema coma. BMJ Case Rep. 2014; 2014: bcr2013010066. https://doi.org/10.1136/bcr-2013-010066
- Murphy J, Philip M, Macken S, Meehan J, Roche E, Mayne PD, et al. Thyroid dysfunction in Down’s syndrome and screening for hypothyroidism in children and adolescents using capillary TSH measurement. J Pediatr Endocrinol Metab. 2008; 21(2): 155-63. https://doi.org/10.1515/jpem.2008.21.2.155
- Ostermaier KK. Down syndrome: Clinical features and diagnosis. En: Drat JE, Firth HV, ed: UpToDate. Waltham, Mass. 2020. https://www.uptodate.com/contents/down-syndrome-clinical-features-and-diagnosis#H12588736.
- Sarmiento MP, Gómez S. Complicaciones endocrinológicas del síndrome de Down en pediatría: revisión de la literatura. Med UIS. 2022; 35(3): 91-103. https://doi.org/ 10.18273/revmed.v35n3-2022010
- Díez Gómez JJ. Hipotiroidismo subclínico. En: Donnay Candil S, ed. Manual de patología tiroidea. Madrid: Enfoque Editorial S.C.; 2018. p. 57-68.
- Radicioni AF, Tahani N, Spaziani M, Anzuini A, Piccheri C, Semeraro A, et al. Reference ranges for thyroid hormones in normal Italian children and adolescents and overweight adolescents. J Endocrinol Invest. 2013; 36(5): 326-30. https://doi.org/10.3275/8581
- Kahapola-Arachchige KM, Hadlow N, Wardrop R, Lim EM, Walsh JP. Age-specific TSH reference ranges have minimal impact on the diagnosis of thyroid dysfunction. Clin Endocrinol (Oxf). 2012; 77(5): 773-9. https://doi.org/10.1111/j.1365-2265.2012.04463.x
- Prasher VP. Down syndrome and thyroid disorders: a review. Downs Syndr Res Pract. 1999; 6(1): 25-42. https://doi.org/10.3104/reviews.95
- Karlsson B, Gustafsson J, Hedov G, Ivarsson SA, Annerén G. Thyroid dysfunction in Down’s syndrome: relation to age and thyroid autoimmunity. Arch Dis Child. 1998; 79(3): 242-5. https://doi.org/10.1136/adc.79.3.242
- Ozgen T, Güven A, Aydin M. Precocious puberty in a girl with Down syndrome due to primary hypothyroidism. Turk J Pediatr. 2009; 51(4): 381-3. PMID: 19950849
- Lim HH, Kil HR, Kim JY. Unusual presentations of a girl with Down syndrome: Van Wyk-Grumbach syndrome. J Pediatr Endocrinol Metab. 2012; 25(11-12): 1209-12. https://doi.org/10.1515/jpem-2012-0195
- Claret C, Goday A, Benaiges D, Chillarón JJ, Flores JA, Hernandez E, et al. Subclinical hypothyroidism in the first years of life in patients with Down syndrome. Pediatr Res. 2013; 73(5): 674-8. https://doi.org/10.1038/pr.2013.26
- Fort P, Lifshitz F, Bellisario R, Davis J, Lanes R, Pugliese M, et al. Abnormalities of thyroid function in infants with Down syndrome. J Pediatr. 1984; 104(4): 545-9. https://doi.org/10.1016/s0022-3476(84)80544-2
- Aversa T, Salerno M, Radetti G, Faienza MF, Iughetti L, Corrias A, et al. Peculiarities of presentation and evolution over time of Hashimoto’s thyroiditis in children and adolescents with Down’s syndrome. Hormones (Athens), 2015; 14(3): 410-6. https://doi.org/10.14310/horm.2002.1574
- Dayal D, Jain P, Panigrahi I, Bhattacharya A, Sachdeva N. Thyroid dysfunction in Indian children with Down syndrome. Indian Pediatr. 2014; 51(9): 751-2. https://doi.org/10.1007/s13312-014-0495-8.